
����Ŀ��ij��ѧ��ȤС������ͼ��װ����ȡ������̽���������й����ʡ�

��1��װ��A����ƿ���Լ���ѡ��__������ţ���
a����ʯ�ҡ�b��Ũ���ᡡc�����������ס�d���Ȼ���
��2����̽���������ܽ��ԣ���װ��D�м��������ر�K1��K2����K3��������Ȫ��ʵ�������__��������K2�ĵ���ĩ������ͼ���е�__װ�ã�����ţ���
��3����̽�������Ļ�ԭ�ԣ���ر�K1��K3��K2���Ӵ���������������װ�á�
���ö���������Ũ������ȡ���������ɵ������������ͨ��ʢ��__�Լ���__�Լ���ϴ��ƿ��
��D�а�����������Ӧ�������̣�ͬʱ����һ����ɫ��ζ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ__��
��β������Cװ�ô�������β���к�������Cl2����Cװ����Ӧʢ��__��Һ���ѧʽ������Ӧ�����ӷ���ʽΪ__��
���𰸡�a ����ë����סԲ����ƿ�ײ�����C �е����е�ˮ����C��ˮ��ʱ������ë������������Ȫ �� ����ʳ��ˮ Ũ���� 3Cl2+8NH3![]() 6NH4Cl+N2 NaOH Cl2+2OH��
6NH4Cl+N2 NaOH Cl2+2OH��![]() Cl��+ClO��+H2O
Cl��+ClO��+H2O
��������
(1)��ˮ�ӷ��������¶��ܴٽ���ˮ�ֽ����ɰ�����Ϊ�ٽ���ˮ�ֽ⣬����ƿ�м������������ˮ���ܷų������ȣ��ҺͰ�ˮ����Ӧ��
(2)������������ˮ���ر�K1��K2����K3������ѹǿ��ձ��е�ˮ�ŵ���ƿ�У���K2�ĵ���ĩ������ͼ���е��ܷ�ֹ������װ�ã�
(3)��Ũ������ȡ�������к����Ȼ��������ˮ����,Ϊ��ֹ����ʵ��,�����ڽ�����ƿǰ,Ӧ���ñ���ʳ��ˮ��Ũ�����ȥ�Ȼ����ˮ������
�ڸ���������ԭ��Ӧ֪, ������������Ӧ�����������Ȼ�泥����ɵ���ɫ��ζ�������ǵ���,���ݷ�Ӧ���������д����Ӧ����ʽ��
��������ˮ��Һ������,���Կ����ü��ȥ������
(1)��ˮ�ӷ�,�����¶��ܴٽ���ˮ�ֽ����ɰ���,Ϊ�ٽ���ˮ�ֽ�,����ƿ�м������������ˮ���ܷų�������,�ҺͰ�ˮ����Ӧ��
a.��ʯ����ˮ�ų�������,��ʹ��ˮ�¶�����,�ҺͰ�ˮ����Ӧ,��aѡ;��
b.Ũ����Ͱ�ˮ��Ӧ,��b��ѡ��
c.�����������ܺͰ�ˮ��Ӧ,��c��ѡ��
d.�Ȼ��ƺͰ�ˮ��Һ�а�����Ӧ���������,�ܽⲻ����,��d��ѡ,��
������ǣ�a��
(2)����ѹǿ��ձ��е�ˮ�ŵ���ƿ�У�����Ϊ����ë������ƿ����,��ƿ�е���������ձ��У����´���ѹǿ������ƿ������ѹǿ���Ӷ�ʹ�ձ��е�ˮͨ�����ܽ�����ƿ�в�����Ȫʵ�飬������������ˮ,Ϊ��ֹ����,���հ�����װ����Ӧ���л���װ��,��װ���ж��л���װ��,��û�л���װ���ܲ�������,������K2�ĵ���ĩ������ͼ���е� I��
������ǣ�����ë����סԲ����ƿ�ײ�����C �е����е�ˮ����C��ˮ��ʱ������ë������������Ȫ����
(3)��Ũ������ȡ�������к����Ȼ��������ˮ������Ϊ��ֹ����ʵ��,�����ڽ�����ƿǰ��Ӧ���ñ���ʳ��ˮ��Ũ�����ȥ�Ȼ����ˮ������
�����Ϊ������ʳ��ˮ��Ũ����;��
�ڸ���������ԭ��Ӧ֪,���ɵ���ɫ��ζ�������ǵ���,�����䷴Ӧ����ʽΪ��3Cl2![]() 8NH3=6NH4Cl
8NH3=6NH4Cl![]() N2,
N2,
�������3Cl2![]() 8NH3=6NH4Cl
8NH3=6NH4Cl![]() N2��
N2��
��������ˮ��Ӧ��������ʹ����ᵼ��������ˮ��Һ������,���Կ���������������Һ��ȥ����,��Ӧ���ӷ���ʽΪ��Cl2![]() 2OH-=Cl-
2OH-=Cl-![]() ClO-
ClO-![]() H2O��
H2O��
�������NaOH��Cl2![]() 2OH-=Cl-
2OH-=Cl-![]() ClO-
ClO-![]() H2O��
H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��������£����Ҵ�����ϩ���Ҵ�ת���ʺ���ϩѡ����(������ϩ�����ʵ������Ҵ�ת�������ʵ����ı�ֵ)���¶ȡ���ϩ������(��λ�� ![]() )�Ĺ�ϵ��ͼ��ʾ(��������������ͬ)��
)�Ĺ�ϵ��ͼ��ʾ(��������������ͬ)��
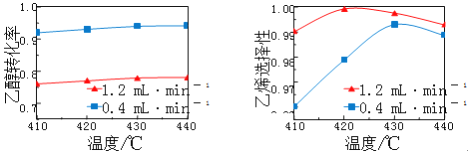
��410~440���¶ȷ�Χ�ڣ�����˵������ȷ����
A. ���Ҵ�������һ�������Ҵ�ת����������ϩѡ��������
B. ���Ҵ�������һ�������¶ȵ����ߣ���ϩѡ���Բ�һ������
C. ���¶�һ�������Ҵ������������Ҵ�ת���ʼ�С
D. ���¶�һ�������Ҵ�������������ϩѡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��һ����Ҫ�Ļ���ԭ������֪A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��B�ɷ���������Ӧ������֮���ת����ϵ��ͼ��
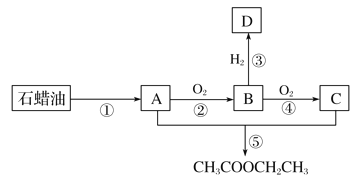
��ش���
(1)�л���B�к��еĹ�����������_______________________________________________��
(2)�����������ӳɷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��_________________________________��
(3)�����������л���D��Ӧ���õ�������������ˮ���μ�2�η�̪��Һ��ˮ��Һ�Ժ�ɫ����ԭ����__________________(�û�ѧ����ʽ��ʾ)��
(4)����˵����ȷ����________��
A���л���A��D��һ�������¿ɷ�Ӧ��������[(CH3CH2)2O]
B�������Ƽ���������ͭ����Һ�������л���B��C��D
C��ͨ��ֱ�����������������л���C�Ļ�������ɷ���õ�������������
D����ͬ��������������������������Һ��ˮ�����ϡ�����и���ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��Mg��Al�ֱ��ϡ�����ַ�Ӧ�õ���ͬ��������������ԭ����(����)
��Fe��Mg��Al�����ʵ�����ȣ�����������
��Fe��Mg��Al����������56��24��27������������
��Fe��Mg��Al����������28��12��9������������
��Fe��Mg��Al�����������������Ũ�Ⱥ��������ͬ��
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ�����������ڴ����а���ȼ�ա�������ijУ��ѧ��ȤС��ѧ���������װ��(ͼ�����еȼг�װ������ȥ)���а����������ڲ�ͬ�����·�Ӧ��ʵ��Աȡ�
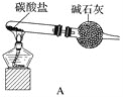
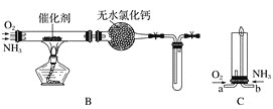
��1����װ��A��ȡ����������İ��������Թ���̼���εĻ�ѧʽ��____________________����ʯ�ҵ�������__________________________��
��2���������İ��������������ͨ��װ��B(����Ϊ��ʯ��)�У��þƾ���Ƽ��ȣ�
�ٰ��������Ļ�ѧ����ʽ__________________���Թ��������Ϊ����ɫ���÷�Ӧ�Ļ�ѧ����ʽ��_______________________��
��ֹͣ��Ӧ�������ر�B������������һ��ʱ����Թܽ����ˮ�У��Թ���������ɫ��dz����˵�����ܵ�ԭ��________________________��
��3����������������A�����İ����ֱ��a��b���ܽ�����ͨ�뵽װ��C�У�����b���϶˵�ȼ�������ɵ�����ˮ��
��������ͨ����Ⱥ�˳����_____________����������______________________��
�ڰ���ȼ�յĻ�ѧ����ʽ��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҽҩ�м���G��һ�ֺϳ�·�����£�

��֪����1��A�ĺ˴Ź�������������壬�ҷ����֮��Ϊ3��1��
��2��G�Ľṹ��ʽΪ��![]() ��
��
��3��![]() ��
��
�ش��������⣺
��1��A��������_____________��B��C�ķ�Ӧ������_____________��
��2��G�ķ���ʽΪ___________��G�й�����������_____________��1 mol G��NaOH��Һ��Ӧ�������______ mol NaOH��
��3��H�Ľṹ��ʽΪ_____________��
��4��D��Ũ������ȵ������»�����һ�ֺ���Ԫ���Ļ����д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________��
��5��I��F��Ϊͬ���칹�壬����������������I�Ľṹ��______�֣�������F����
�ٱ�����������ȡ����������FeCl3��Һ����ɫ��������NaOH��Ӧ��
��6����������������Ϣ��д���ɱ��ӣ��ױ�Ϊԭ���Ʊ������ᱽ�����ĺϳ�·��(�������Լ���ѡ)��_________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ֻ�����Ӧ���ͣ�������������ԭ��Ӧ���ǣ� ��
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl��+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CeO2)��һ����Ҫ��ϡ��������Է�̼���(��Ҫ��CeCO3F)Ϊԭ���Ʊ�CeO2��һ�ֹ����������£�
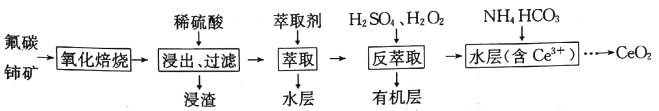 ��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��.��������ϵ��Ce4+�ܱ���ȡ��[(HA)2]��ȡ����Ce3+����
��.�����£�Ce2(CO3)3������ҺŨ��Ϊ1.0��10-6mol��L-1��
�ش��������⣺
��1�������������������п��Լӿ췴Ӧ���ʺ����ԭ�������ʵķ�����__________��__________ (д��2�ּ���)��
��2��д������������������CeO2��ϡH2SO4��Ӧ�����ӷ���ʽ��__________��
��3������ȡ��ʱ���ڷ�Ӧ��Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=
Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=![]() )�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
)�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
��4�������������ɵ�Ce(BF4)3������KCl��Һ�������·�Ӧ��
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)��
3KBF4(s)+ Ce3+(aq)��
��һ���¶�ʱ��Ce(BF4)3��KBF4��Ksp�ֱ�Ϊa��b����÷�Ӧ��ƽ�ⳣ��K=__________(��a��b��ʾ)��
��5��������ȡ���м�H2O2����Ҫ��Ӧ���ӷ���ʽΪ__________����������ȡ��������ˮ���м���1.0mol��L-1��NH4HCO3��Һ������Ce2(CO3)3��������Ce3+������ȫʱ[c(Ce3+)=1��10-5mol��L-1]����Һ��c(CO32-)ԼΪ__________��
��6��CeO2������β�����������Ĺؼ��ɷ֣������ڻ�ԭ�����й����������������к�������β�����������з�����CeO2![]() CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵ�ԭ������������������AԪ��ԭ�ӵĺ���p��������s��������1��C�ǵ縺������Ԫ�ء�Dԭ�Ӵ���������������������2����E�ǵ�������ԭ��������С��Ԫ�ء�
��1��д����̬Cԭ�ӵĵ����Ų�ʽ_________________��
��2��A��B����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________(��Ԫ�ط��ű�ʾ)��ԭ����___________________��
��3����֪DC4������Ϊ���壬������ʵľ���������_________�������������ԭ�ӵĹ���ӻ�����Ϊ____________���ռ乹����___________��
��4��Cu2��������AH3�γ�������[Cu(AH3)4]2������AC3������Cu2���γ������ӣ���ԭ����______________________��
��5��A��B��Ԫ�طֱ���D�γɵĹ��ۼ��У����Խ�ǿ����__________��A��B��Ԫ�ؼ����γɶ��ֶ�Ԫ�����������A3����Ϊ�ȵ���������ʵĻ�ѧʽΪ__________��
��6����֪E���ʵľ�����ͼ��ʾ��������Eԭ�ӵ���λ��Ϊ__________��һ��E�ľ�������Ϊ___________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com