
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl↓+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【答案】A
【解析】
离子反应是有离子参加或生成的反应,有元素化合价变化的反应为氧化还原反应,据此分析解答。
A. Fe+CuSO4=FeSO4+Cu是在溶液中进行的置换反应,是离子反应,离子方程式是Fe+Cu2+=Fe2++Cu,其中Fe、Cu两种元素的化合价发生了变化,该反应同时又属于氧化还原反应,故A选项合理;
B. 3CO+Fe2O3![]() 2Fe+3CO2有元素化合价的变化,属于氧化还原反应;但不属于离子反应,不符合题意,选项B错误;
2Fe+3CO2有元素化合价的变化,属于氧化还原反应;但不属于离子反应,不符合题意,选项B错误;
C. AgNO3+NaCl=AgCl↓+NaNO3是在溶液中进行的复分解反应,属于离子反应,离子方程式是Ag++Cl-=AgCl↓,但是没有元素化合价的变化,不是氧化还原反应,选项C错误;
D. 2KMnO4![]() KMnO4+MnO2+O2↑是固态物质进行的化学反应,有元素化合价的变化,属于氧化还原反应,但不是离子反应,故选项D不符合题意;
KMnO4+MnO2+O2↑是固态物质进行的化学反应,有元素化合价的变化,属于氧化还原反应,但不是离子反应,故选项D不符合题意;
本题合理选项是A。


科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成Al(OH)3的质量,横坐标表示加入试剂的体积。下列叙述中不正确的是( )
A. 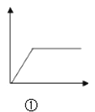 图①可表示向NH3·H2O中滴加AlCl3溶液至过量
图①可表示向NH3·H2O中滴加AlCl3溶液至过量
B. 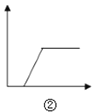 图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
C. 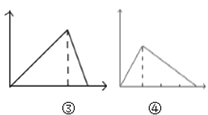 图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
D. 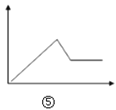 图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
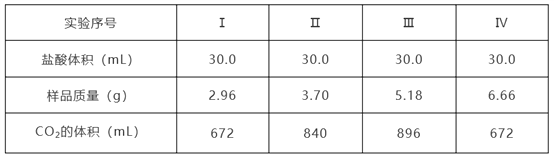
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2)盐酸的物质的量浓度c(HCl)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期主族元素,X、Y在周期表中的相对位置如图所示,Xn-、Ym+、Z+具有相同的电子层结构,W的最内层电子数与最外层电子数之和等于次外层电子数。下列说法正确的是
![]()
A. 原子半径:r(X)>r(Y)>r(Z)>r(W)
B. X形成的氧化物的种类最多为4种
C. 最高价氧化物对应水化物的碱性:Z<Y
D. Y、Z、W对应的最高价氧化物的水化物之间能够两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钠、镁、铝、铁四种金属单质中的两种组成的合金共24g,跟足量的盐酸反应产生11.2L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】373K时,某 1L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)![]() N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
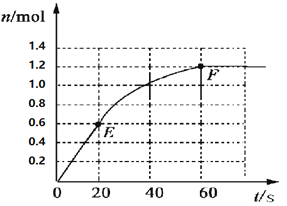
(1)前20 s内NH3(g)的平均反应速率为___________;
(2)373K时该反应的平衡常数的值为______________;
(3)若在此平衡体系中再加入1mol的NH3,与原平衡比较,新平衡时NH3的转化率______(填“增大”或“减小”,下同),NH3的平衡浓度_________。
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为_________(填“放热反应”或“吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)______。
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。

(1)装置B、C中应盛放的试剂名称分别为__________、_________;从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是___________________________。
(2)实验时,先点燃A处的酒精灯,让氯气充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:______________________。
(3)F装置所起的作用是____________________,____________________。
(4)用石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式: _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com