
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【答案】B
【解析】由题中信息可知,反应在第7分钟处于化学平衡状态,平衡时Y的变化量为0.06mol,则根据方程式可知
X(g) + Y(g)![]() 2Z(g)
2Z(g)
起始浓度(mol/L) 0.016 0.016 0
转化浓度(mol/L) 0.006 0.006 0.012
平衡浓度(mol/L) 0.01 0.01 0.012
A.反应前2min内Y减少了0.04mol,则生成Z是0.08mol,浓度是0.008mol/L,所以平均速率v(Z)=0.008mol/L÷2min=4.0×10-3mol/(L·min),A错误;B. 该反应为放热反应,其他条件不变,降低温度,化学平衡向正反应方向移动,反应达到新平衡前v(逆)<v(正),B正确;C. 该温度下此反应的平衡常数K=![]() ,C错误;D. 该反应前后气体的分子数不变,所以改变压强后,平衡不移动。其他条件不变,再充入0.2molZ,相当于对原平衡加压,所以平衡时X的体积分数不变,D错误。答案选B。
,C错误;D. 该反应前后气体的分子数不变,所以改变压强后,平衡不移动。其他条件不变,再充入0.2molZ,相当于对原平衡加压,所以平衡时X的体积分数不变,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
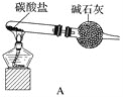
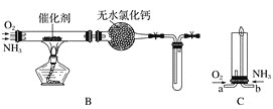
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________;碱石灰的作用是__________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________;试管内气体变为红棕色,该反应的化学方程式是_______________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________,其理由是______________________。
②氨气燃烧的化学方程式是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl↓+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
①容器内气体压强保持不变
②吸收y mol H2只需1 mol MHx
③若降温,该反应的平衡常数增大
④若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(3)化工生产的副产物也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解过程中,须将阴极产生的气体及时排出,其原因是_______。
②c(Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
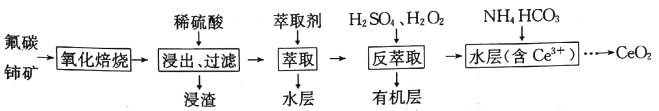 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫渣是铁水在进入转炉前进行脱硫处理时产生的废弃物,现以某工厂废弃的脱硫渣(主要成分为Fe、CaO及少量MgO、Al2O3、SiO2)为原料,制备高纯度硫酸亚铁晶体的流程如下:
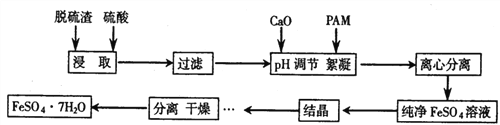
(1)在结晶过程中,pH、温度对硫酸亚铁纯度的影响如图1、图2,则蒸发结晶时适宜的条件为_____。
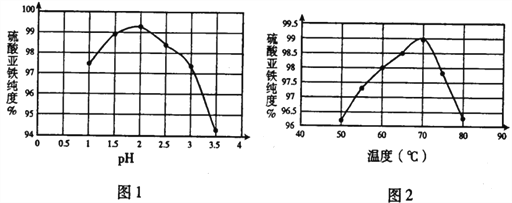
(2)离心分离后在30℃下干燥6h后得高纯度硫酸亚铁晶体,30℃下干燥其原因可能是______。
(3)实验室进行过滤操作时所需用到的玻璃仪器有_______。
(4)硫酸亚铁晶体可用来净化硫酸亚铁晶体可用来净化含K2Cr2O7废水,取一定质量的FeSO4·7H2O 和足量的KOH溶液加入到含K2Cr2O7废水中可得到一定量的磁性材料Cr0.5Fe1.5FeO4,处理含5.00×10-3mol K2Cr2O7的废水,需要多少克的FeSO4·7H2O(写出计算过程)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com