
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
①容器内气体压强保持不变
②吸收y mol H2只需1 mol MHx
③若降温,该反应的平衡常数增大
④若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(3)化工生产的副产物也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解过程中,须将阴极产生的气体及时排出,其原因是_______。
②c(Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:__________。
【答案】 < ① ③ 防止Na2FeO4与H2反应使产率降低 N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
【解析】(1)已知:①H2(g)+A(l)=B(l) ΔH1
②O2(g)+B(l)=A(l)+H2O2(l) ΔH2
两反应的ΔS<0,根据ΔG=ΔH-TΔS,因为两个均为自发反应,因此ΔH均小于0,将①+②得:H2(g)+ O2(g)= H2O2(l)的ΔH=ΔH1+ΔH2<0 ;(2) ①、平衡时气体的物质的量不变,压强不变,选项①正确;②、该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,选项②错误;③、正反应是放热反应,升高温度,平衡向逆反应分析移动,平衡常数减小,选项③错误;④、向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),选项④错误;答案选① ③;(3)①电解过程中,须将阴极产生的气体及时排出,其原因是防止Na2FeO4与H2反应使产率降低;②c( Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
点晴:本题考查的知识点较多,以氢气利用为线索考查了化学反应中的能量变化、电解原理及其应用、化学平衡的移动及其影响因素等相关知识。在书写燃料电池电极反应时,要注意掌握一般的书写方法:①电极反应是一种离子反应,遵循书写离子反应的所有规则;②将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;③负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);④溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。本题的易错点和难点是c(Na2FeO4)低于最高值的原因分析。分析时,要注意从题目中寻找线索并结合反应的特征分析。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
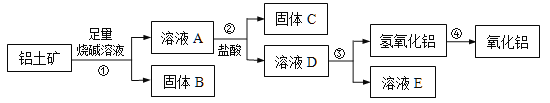
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1 mol电子,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23 g Na与足量H2O反应完全后可生成NA个H2分子
B. 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4 L Cl2含NA个原子
D. 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期主族元素,X、Y在周期表中的相对位置如图所示,Xn-、Ym+、Z+具有相同的电子层结构,W的最内层电子数与最外层电子数之和等于次外层电子数。下列说法正确的是
![]()
A. 原子半径:r(X)>r(Y)>r(Z)>r(W)
B. X形成的氧化物的种类最多为4种
C. 最高价氧化物对应水化物的碱性:Z<Y
D. Y、Z、W对应的最高价氧化物的水化物之间能够两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是
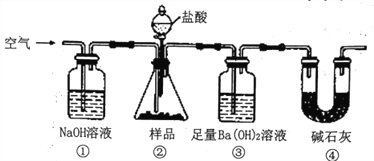
A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的____________________性。
②误食重金属盐会使人中毒,应口服_______________来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了___________________(化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是_____________。

(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是______________。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是___________(填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式__________。青椒、西红柿等蔬菜富含维生素C,维生素C 又称____________酸,用淀粉溶液和碘水可检验维生素C的_________性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的__________(填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式____________________________________。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式__________。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化
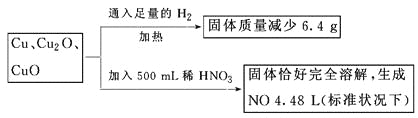
则转化过程中所加稀HNO3的物质的量浓度为
A. 4.4 mol·L-1 B. 3.6 mol·L-1 C. 4.0 mol·L-1 D. 3.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com