
����Ŀ��ij����С���о���������Al2O3����������֪����������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2����������������ȡAl2O3�Ĺ���������
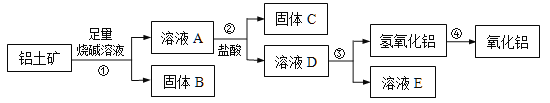
��1������B����Ҫ��;����д��1��������________________��
��2�������������������м��������ռ���Һ��������Ӧ�����ӷ���ʽ�� �� ��
�������У��������������Ļ�ѧ����ʽ�� ��
��3����ʵ����������ù��徫ȷ����������С�鷢�������������������������ԭ������������ȣ������������Al2O3������������_______��������һλС����
��4����ҵ����ȡAlCl3��Al2O3��C��Cl2�ڸ��������·�Ӧ��ÿ����0��5 mol ̼���ʣ�ת��1 mol���ӣ���Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡���1������ԭ��������Ϳ�ϡ������
��2��Al2O3+2OH��= 2AlO2��+H2O SiO2+2OH��= SiO32��+ H2O
AlCl3 +3NH3��H2O = Al��OH��3��+ 3NH4Cl
��3��65��4%
��4��Al2O3+3Cl2+3C![]() 2AlCl3 +3CO
2AlCl3 +3CO
��������
�����������1������������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2�������������м���NaOH��Һ������Al2O3��SiO2����NaOH��Ӧ����˹���BΪFe2O3����Ҫ��;������ԭ��������Ϳ�ϡ����������2�����������м��������ռ���Һ��Al2O3��NaOH��Ӧ����NaAlO2��SiO2��NaOH��Ӧ����Na2SiO3�����ӷ���ʽΪ��Al2O3+2OH��= 2AlO2��+H2O ��SiO2+2OH��= SiO32��+ H2O ������ҺA�м������ᣬ����CΪH2SiO3����ҺDΪAlCl3��NaCl���������У�����ҺD���백ˮ����ˮ��AlCl3��Ӧ�����������������ӷ���ʽΪ��AlCl3 +3NH3��H2O = Al��OH��3��+ 3NH4Cl����3����������������������Ϊm����ԭ�����������Ϊm������Ԫ�ص����ʵ���Ϊ��![]() ����Al2O3�����ʵ���Ϊ��
����Al2O3�����ʵ���Ϊ��![]() ����ԭ��������Al2O3������Ϊ��
����ԭ��������Al2O3������Ϊ��![]() ������������Al2O3��������������
������������Al2O3��������������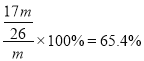 ����4��ÿ����0��5 mol ̼���ʣ�ת��1 mol���ӣ���̼Ԫ�ػ��ϼ���0������Ϊ+2�ۣ�������ɵIJ�����CO��AlCl3 ���ʷ�Ӧ�Ļ�ѧ����ʽΪ��Al2O3+3Cl2+3C
����4��ÿ����0��5 mol ̼���ʣ�ת��1 mol���ӣ���̼Ԫ�ػ��ϼ���0������Ϊ+2�ۣ�������ɵIJ�����CO��AlCl3 ���ʷ�Ӧ�Ļ�ѧ����ʽΪ��Al2O3+3Cl2+3C ![]() 2AlCl3 +3CO��
2AlCl3 +3CO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڷ��ȷ�Ӧ����(����)
A. Ũ�����ϡ�� B. ���ȷ�Ӧ
C. ������ԭ����ͭ D. Ba(OH)2��8H2O�����NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֵ������У�����100���ļ����� ��������
A. ��������ֻ��һ����100����������ɵĶ�����
B. �������к���������51����������ɵĶ�����
C. �������к���������34����������ɵĶ�����
D. �������к���������27����������ɵĶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)��O2(g) ![]() 2SO3(g) ��H����197 kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2 mol SO2��1 mol O2��(��)1 mol SO2��0.5 mol O2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3(g) ��H����197 kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2 mol SO2��1 mol O2��(��)1 mol SO2��0.5 mol O2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
A��������ѹǿP��P����P����2P��
B��SO2������m��m����m����2m��
C��c(SO2)��c(O2)֮��k��k����k����2k��
D��������SO2��ת���ʷֱ�Ϊ�ס���������SO3��ת����Ϊ��������������+��=1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƾ��ڴ�Ź����У��в����Ҵ�ת��Ϊ���ᣬ���»ƾƱ��ᡣ�ù����з����ķ�ӦΪ
A. ȡ����Ӧ B. �ӳɷ�Ӧ C. ������Ӧ D. ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����F��Cl��Br��I˳���������(����)
A. ��Χ���� B. ��һ������ C. �縺�� D. ԭ�Ӱ뾶
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ�����Խ���ܶ����⡣
��1����ȷ�������������ڶ��Ե缫���ԶƲ���ʽ�����Ľ�������,����ȷ����������ͨ�����صĵ�����ʵ�ʲ����г��õ��������ƽṹ��ͼ��ʾ��

���������е�����Ӧ���Դ�������������������Ϸ����ĵ缫��Ӧ��_____________��
��ʵ���У�Ϊ�˱������ܽ�����п��ܲ����Ľ��������������������²������������缫��������һ���ռ���������û���ռ����������������____________(����ƫ��"��ƫ����������Ӱ����)��
����Ҫ�ⶨ��⾫��ͭʱͨ���ĵ������ɽ������������е������������ص�________�缫������
��2����ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���С�

��K1�պϣ������Ϸ����ķ�ӦΪ______________��
��K2�պϣ��������ᱻ��ʴ������_________��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦX(g)��2Y(g)![]() Z(g) ��H��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����
Z(g) ��H��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����

A������������м���1mol X��2mol Y����ƽ��ʱ��X��ƽ��Ũ��С��0.125 mol/L
B��a������Ӧ���ʴ����淴Ӧ����
C����Ӧ��ƽ��ʱ�������¶ȿ���ʵ��c��d��ת��
D���������£���Ӧ��ƽ��ʱ��ƽ�ⳣ��K=3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��Ȫˮ��ȡ0.5 L����Ȫˮ��Ϊ��Ʒ�����ⶨ����Ʒ�к���48.00 mg��Mg2+�� ��ô����Ȫˮ��Mg2+�����ʵ�����Ũ���Ƕ��٣�Ϊʹ��Ȫˮ��Ʒ������Mg2+ȫ��������Ӧ����1mol/L NaOH��Һ������Ƕ��٣�(��д����Ҫ�������)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com