
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-197 kJ·mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) ΔH=-197 kJ·mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.SO2的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙=2k乙
D.甲乙中SO2的转化率分别为甲、乙,丙中SO3的转化率为丙:甲>乙,甲+丙=1
【答案】D
【解析】
试题分析:恒温恒容条件下,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,反应物的转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应各组分的物质的量相等。A、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙,故容器内压强P:P甲=P丙<2P乙,错误;B、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故SO2的质量m:m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol SO2和0.5mol O2,增大压强,平衡向正反应移动,SO2转化率增大,则SO2的质量m:m甲<2m乙,错误;C、对于甲、乙容器,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故c(SO2)与c(O2)之比k:k甲=k丙=k乙,错误;D、恒温恒容条件下,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,反应物的转化率增大,则甲乙中SO2的转化率:甲>乙 ,丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应各组分的物质的量相等,则甲+丙=1,正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】抗禽流感药物达菲可用莽草酸为原料来合成。莽草酸结构简式如图所示。下列说法正确的是

A.莽草酸的化学式为C7H6O5
B.1mol莽草酸最多能和4molNaOH发生反应
C.莽草酸分子中所有碳原子共平面
D.莽草酸在一定条件下可以发生取代、加成、消去、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
元素 | X | Y | Z |
最高、最低化合价 | +7 -1 | +6 -2 | +5 -3 |
A. 原子序数:X>Y>Z
B. 原子半径:X>Y>Z
C. 稳定性:HX>H2Y>ZH3
D. 酸性由强到弱:HXO4>H2YO4>H3ZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
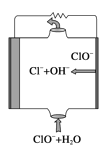
A.放电过程中OH-移向正极
B.电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
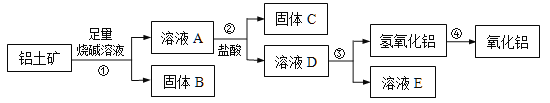
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1 mol电子,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiO(OH)+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应分别是
①_____________________________________;
②_____________________________________。
(3)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应_______________________.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_____________。
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
(5)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。

请回答:a为________(填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)为:______________;写出此时电解反应的总化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com