
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化
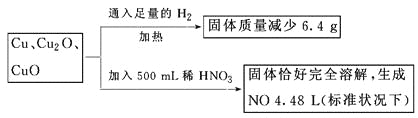
则转化过程中所加稀HNO3的物质的量浓度为
A. 4.4 mol·L-1 B. 3.6 mol·L-1 C. 4.0 mol·L-1 D. 3.2 mol·L-1
【答案】D
【解析】
试题设其中每一份中含有各部分的物质的量分别是:n(Cu)="x" mol,n(Cu2O)="y" mol,n(CuO)="z" mol,根据电子守恒可得2x+2y=(4.48L÷22.4L/mol)×3=0.6mol,根据氧元素守恒可得y+z=6.4g÷16g/mol=0.4mol;两个式子相加可得:x+2y+z=0.7mol,即反应后生成的硝酸铜的物质的量为0.70mol.所以在500mL稀硝酸中含有硝酸的物质的量是: n(HNO3)=0.70mol×2+0.20mol=1.600mol,硝酸的浓度是:c(HNO3)=n÷V=1.60mol/0.50L=3.2mol/L,因此选项是D。


科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
①容器内气体压强保持不变
②吸收y mol H2只需1 mol MHx
③若降温,该反应的平衡常数增大
④若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(3)化工生产的副产物也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解过程中,须将阴极产生的气体及时排出,其原因是_______。
②c(Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是

A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的4/5,则原混合气体中N2的体积分数为
A. 33.3% B. 40% C. 60% D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的氮氧化合物(NOx)与大气中的NH3发生如下作用,形成一种雾霾。
NOx ![]() N2O5
N2O5 ![]() HNO3
HNO3 ![]() 烟(一种雾霾)
烟(一种雾霾)
有关该雾霾的叙述错误的是( )
A. 该雾霾中含硝酸铵固体 B. 反应②是非氧化还原反应
C. NH3是形成该雾霾的催化剂 D. NH3可能来自过度施用氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在镁屑和无水乙醚的混合体系中,滴加卤代烷,反应后得到的有机镁化合物称为格氏试剂。制备的格氏试剂不需要分离就可直接用于有机合成,是重要的有机合成中间体。反应原理为:![]()
利用A(![]() )来合成
)来合成 的流程如图所示:
的流程如图所示:

(1)物质A的名称为________;
(2)A![]() B的反应类型是_________;
B的反应类型是_________;
(3)写出由F生成G、G生成H的化学方程式:_____________________________;
(4)D的同分异构体中含有六元环且能发生银镜反应的有___________种;
(5)写出符合下列要求的I的同分异构体的结构简式_________;(写一种即可,已知同一个碳原子上不能连接2个羟基)
①芳香族化合物 ②二元醇 ③分子中有5种不同化学环境的H原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的物质的量不再变化;⑥单位时间消耗amol A,同时生成2amol C;⑦A、B、C的分子数目比为1:3:2。
A. ②⑤⑥ B. ①③⑥ C. ②⑥⑦ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:

第③个实验中,生成白色沉淀的量与加入![]() 的量有如下图所示的相互关系。据此可知:
的量有如下图所示的相互关系。据此可知:

(1)在原溶液中一定存在的离子有______;一定不存在的离子有______;不能确定是否存在的离子有______。
(2)写出第③个实验中发生反应的离子方程式____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com