
【题目】有一无色溶液,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:

第③个实验中,生成白色沉淀的量与加入![]() 的量有如下图所示的相互关系。据此可知:
的量有如下图所示的相互关系。据此可知:

(1)在原溶液中一定存在的离子有______;一定不存在的离子有______;不能确定是否存在的离子有______。
(2)写出第③个实验中发生反应的离子方程式____________________________________。
【答案】Al3+、Mg2+、K+、![]() Fe3+、Fe2+、Cu2+、Ba2+ Cl Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===
Fe3+、Fe2+、Cu2+、Ba2+ Cl Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===![]() +2H2O
+2H2O
【解析】
由题意,溶液无色,则Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)一定不存在;焰色反应显紫色,说明一定有K+;实验②说明一定有![]() ,则Ba2+一定不存在;由实验③以及图像可知一定有Mg2+、Al3+,而Cl通过上述四个实验无法确定。
,则Ba2+一定不存在;由实验③以及图像可知一定有Mg2+、Al3+,而Cl通过上述四个实验无法确定。
(1)由上述分析可知,在原溶液中一定存在的离子有Al3+、Mg2+、K+、![]() ,一定不存在的离子有Fe3+、Fe2+、Cu2+、Ba2+,不能确定是否存在的离子有Cl;
,一定不存在的离子有Fe3+、Fe2+、Cu2+、Ba2+,不能确定是否存在的离子有Cl;
(2) 在原溶液中存在的离子Al3+、Mg2+,加入足量氢氧化钠溶液时,生成氢氧化镁沉淀,过量的氢氧化钠使铝离子生成偏铝酸根,溶液中发生反应的离子方程式为Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的为( )
A.气体摩尔体积就是22.4 L/mol
B.1 mol H2的质量只有在标况下才约为2 g
C.标况下,18克H2O的体积为22.4 L
D.H2和O2的混合气体1 mol在标况下的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且常温常压下为气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
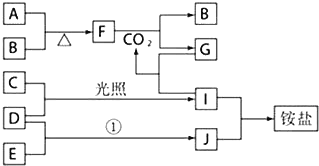
请按下列要求填空:
(1)CO2的电子式____.A的原子结构示意图________,
(2)化合物I的沸点比J的沸点____(填“高”或“低”),理由是 _________。
(3)化合物F中,阳离子与阴离子个数比是____。
(4)写出F和CO2反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中
B.蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解
C.蒸馏时需从冷凝管上口进水,下口出水
D.分液时,下层液体放完后,再从下口放出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)![]() xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化过程中的颜色变化。实验时必须使用铁屑和6 mol·L1的硫酸,其他试剂任选。
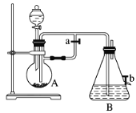
请回答下列问题:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的物质是__________________,A中反应的离子方程式是____________________________________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。其目的是____________________。
(3)简述生成Fe(OH)2的操作过程:__________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为_________________。
(5)图中________(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,回答下列问题:
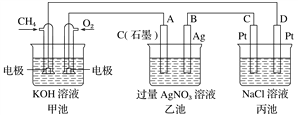
(1)甲池是_________装置,乙装置中电极A的名称是_____________。
(2)甲装置中通入O2的电极反应式为______________________,乙装置中电极B(Ag)的电极反应式为_____________________,丙装置中D极的产物是____________(写化学式)。
(3)一段时间,当丙池中产生气体共112 mL(标准状况)时,均匀搅拌丙池,所得溶液的pH=_____(温度为25 ℃时,并已知NaCl溶液足量,不考虑生成的气体在溶液中的溶解和反应,电解后溶液体积为500 mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com