
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ���ش��������⣺
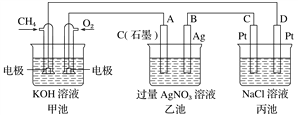
��1���׳���_________װ�ã���װ���е缫A��������_____________��
��2����װ����ͨ��O2�ĵ缫��ӦʽΪ______________________����װ���е缫B(Ag)�ĵ缫��ӦʽΪ_____________________����װ����D���IJ�����____________(д��ѧʽ)��
��3��һ��ʱ�䣬�������в������干112 mL(��״��)ʱ�����Ƚ�����أ�������Һ��pH��_____(�¶�Ϊ25 ��ʱ������֪NaCl��Һ���������������ɵ���������Һ�е��ܽ�ͷ�Ӧ��������Һ���Ϊ500 mL)��
���𰸡� ԭ��� ���� O2+4e-+2H2O=4OH- Ag++e-=Ag H2 12
����������1���׳��м�������ԭ�����ǵ�صĸ������׳���ԭ���װ�ã���װ���е缫A��ԭ��ص�����������A����������������2����װ����ͨ��O2�ĵ缫��ԭ��ص���������ӦʽΪO2+4e-+2H2O=4OH-����װ���е缫B(Ag)�ǵ��ص��������缫��ӦʽΪ Ag++e-=Ag����װ����D���ǵ���������H���õ���������������װ����D���IJ�����H2����3��������������Ƶ����ʵ���Ũ����xmol��L��1�������в���112mL��������������������������ͬ��Ϊ56ml��
2NaCl+2H2O![]() H2��+Cl2��+2NaOH
H2��+Cl2��+2NaOH
22.4L 2mol
0.056L 0.5xmol
��x=![]() =0.01mol��L��1����C��H����=10-12 mol��L��1��������Һ��pH=12��
=0.01mol��L��1����C��H����=10-12 mol��L��1��������Һ��pH=12��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫ��Һ�����п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �������еļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й��������£�
�������еļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й��������£�

�ڢ۸�ʵ���У����ɰ�ɫ�������������![]() ����������ͼ��ʾ�����ϵ���ݴ˿�֪��
����������ͼ��ʾ�����ϵ���ݴ˿�֪��

��1����ԭ��Һ��һ�����ڵ�������______��һ�������ڵ�������______������ȷ���Ƿ���ڵ�������______��
��2��д���ڢ۸�ʵ���з�����Ӧ�����ӷ���ʽ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.ͬ��ͬѹ�£���ͬ��������ʣ������ʵ���һ�����
B.�κ������£������ʵ����ļ����һ����̼�����ķ�����һ�����
C.1Lһ����̼����һ����1L����������С
D.��ͬ�����µ�һ����̼����͵����������ʵ�������������ȣ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. 0.1 mol��L��1��Na2CO3��Һ�У�c(OH��)��c(HCO![]() )��c(H��)��c(H2CO3)
)��c(H��)��c(H2CO3)
B. 25 ��ʱ���ô�����Һ�ζ���Ũ��NaOH��Һ��pH��7��V������VNaOH
C. �����½�10mlpH=4�Ĵ�����Һϡ����100ml,������Һ4<pH��5
D. ��NaAlO2��Һ�еμ�NaHCO3��Һ��ٽ�ˮ�⣬�г�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ϵͳ�����У���ȷ����( )
A. ![]() 2��4����������
2��4����������
B. ![]() 2������4����Ȳ
2������4����Ȳ
C. ![]() 2,3-����-2,4-���ϩ
2,3-����-2,4-���ϩ
D. 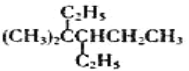 4��4��������3���һ�����
4��4��������3���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ʾװ�ã���ƽ����ƿ�ĵײ���һ���ƣ�ƽ����ƿ���Ǹ���Ŀ�����

��һ��ʱ���ɹ۲쵽______________��������Ӧ�Ļ�ѧ����ʽΪ___________________��
��2��ij��ͬѧ����ͼ��ʾװ�òⶨ�����������ĺ��������õ��ɼм�ס�ܡ���ȼ�ƣ�����ƿ�в�����ƿ��������Ϩ����ȴ���ɼУ��۲���ƿ��ˮ��ı仯�����

������ʵ������з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ʵ����ϣ���ͬѧ�Ĺ��ƿ��ˮ����������С��ƿ�ڿ��������1/5����ͬѧ�Ĺ��ƿ��ˮ���������Դ���ƿ�ڿ��������1/5�����ж�������������ͺ�������________��
a����ͬѧ����ʹ���Ƶ������㣬ƿ������û��������
b����ͬѧ����δ����ƿ������Ϩ����ȴʱ����������ƿ��
c����ͬѧ����û�н����ɼУ���ȼ��ʱƿ�ڲ��ֿ������ȴӵ����ݳ�
d����ͬѧ���ܲ���ȼ�ճ�̫��������ƿ��֮ǰ��ƿ�ڲ��ֿ��������ݳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL NaOH��Һ��Ͷ��10.8 g Al������ǡ����ȫ��Ӧ������㣺
��1��Al�����ʵ�����
��2���μӷ�Ӧ��NaOH�����ʵ�����ԭ��Һ�����ʵ����ʵ���Ũ�ȡ�
��3���ڱ�״��������H2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����0.1 mol��L��1CuSO4��Һ480 mL�������в������������ʵ������֣���ʹ��������������
(1)ѡ����������ɱ�ʵ��������������У�������ƽ(��ȷ��0.1 g)��ҩ�ס��ձ�����Ͳ����������________��________�Լ�����������Ƭ��ֽ��
(2)���㣬Ӧѡ������________��
A����ҪCuSO4����8 g B����ҪCuSO4����7.7 g
C����ҪCuSO4��5H2O����12.5 g D����ҪCuSO4��5H2O����12.0 g
(3)��������������������������Һ��Ũ�Ȼ�_____(�ƫ�ߡ���ƫ�͡�����Ӱ�족��
(4)�ܽ⡢��ȴ���ò�ʵ������Ҫʹ�ò�������Ŀ����____________________��
(5)ת�ơ�ϴ�ӡ���ת��ʱӦʹ��________��������Ҫϴ���ձ�2��3����Ϊ��________��
(6)���ݣ�ҡ�ȡ�
(7)����õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�����ñ�ǩ��ע�����Ƶ�ʱ�䡢��Һ���Ƽ�Ũ�ȡ�
(8)�����ƹ����У�ijѧ���۲춨��ʱҺ�������ͼ��ʾ��������Һ��Ũ�Ȼ�________(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��C��N��O��Si��S �Ǽ��ֳ�������Ҫ�ǽ���Ԫ�أ����γɵĸ��ֻ���������Ȼ���й㷺����

��1��Siλ��Ԫ�����ڱ���______����______�壻��̬��ԭ�ӵĵ����Ų�ʽΪ______��C��N��SiԪ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ______��
��2��BF3��һ������ˮ���γ���ͼ1����R������R�и������������������______������ĸ����
a�����Ӽ� b�����ۼ� c�����»��� d��������
��3���Ҷ�����H2N��CH2��CH2��NH2����CuCl2��Һ���γ������ӣ��ṹ��ͼ2�����Ҷ��������װ�[N��CH3��3]�����ڰ������Ҷ��������װ��ķе�ߵö࣬ԭ����______��
��4����25�桢101kpa��NO2��g����SO2��g����Ӧ���� SO3��g���� NO��g������֪ÿ����1gSO3��g���ų����� 0.52kJ���÷�Ӧ���Ȼ�ѧ����ʽ��______��
��5����ɰ��Na2B4O710H2O��������������ɱ�����������ˮ����������Һ�л�����H3BO3���÷�Ӧ�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com