
【题目】向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,请计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液中溶质的物质的量浓度。
(3)在标准状况下生成H2的体积。
【答案】(1)0.4 mol(2)0.8 mol·L-1(3)13.44 L
【解析】
试题(1)根据n=![]() 计算Al的物质的量;
计算Al的物质的量;
(2)发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算NaOH的物质的量,根据c=![]() 计算其物质的量浓度;
计算其物质的量浓度;
(3)根据方程式计算氢气的物质的量,再根据V=nVm计算其体积.
解:(1)10.8gAl的物质的量为:![]() =0.4mol,
=0.4mol,
答:10.8gAl的物质的量为0.4mol;
(2)设参加反应的NaOH的物质的量为x mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2
0.4mol xmol
则:2:2=0.4mol:x mol,解得:x=0.4,
故NaOH溶液的物质的量浓度为:![]() =0.8mol/L,
=0.8mol/L,
答:参加反应的NaOH的物质的量为0.4mol,NaOH溶液的物质的量浓度为0.8mol/L;
(3)设生成氢气的物质的量为y mol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.4mol ymol
则:2:3=0.4mol:y mol,解得:y=0.6,
所以生成氢气在标准状况下的体积为:0.6mol×22.4L/mol=13.44L,
答:生成氢气的体积为13.44L.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,回答下列问题:
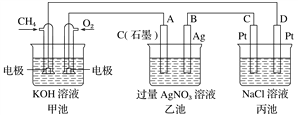
(1)甲池是_________装置,乙装置中电极A的名称是_____________。
(2)甲装置中通入O2的电极反应式为______________________,乙装置中电极B(Ag)的电极反应式为_____________________,丙装置中D极的产物是____________(写化学式)。
(3)一段时间,当丙池中产生气体共112 mL(标准状况)时,均匀搅拌丙池,所得溶液的pH=_____(温度为25 ℃时,并已知NaCl溶液足量,不考虑生成的气体在溶液中的溶解和反应,电解后溶液体积为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
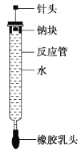
(1)钠与水反应的离子方程式为__________________________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_____________________;向烧杯中的溶液中滴加____________,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____________g(设当时实验条件下气体摩尔体积为V mL/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。反应的化学方程式是___________________________________;样品中铝的质量为________g。
(2)另取a g样品将其点燃,恰好完全反应,该反应的化学方程式是2Al+Fe2O3![]() 2Fe+Al2O3,氧化铁与铝的质量比是________。
2Fe+Al2O3,氧化铁与铝的质量比是________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下图所示(部分反应条件及产物略去):
![]()
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为_________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为___。
A和C是否可以发生反应______(填“能”或“不能”),若能,反应的化学方程式为____________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化碳转化为燃料是目前的研究热点,2017年《科学》杂志报道的一种将CO2转化为烃和醇的装置如图所示。下列说法正确的是

A. 图中能量转化的方式只有1种
B. 装置工作时,H+向X极区移动,Y极周围溶液的pH增大
C. X极上得到CH3OH的电极反应式为2CO2+4H2O+12e-==2CH3OH+3O2
D. 若X极生成1molC2H4和lmolCH3OH,电路中流过18mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-
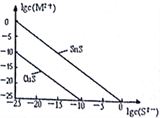
①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com