
【题目】脱硫渣是铁水在进入转炉前进行脱硫处理时产生的废弃物,现以某工厂废弃的脱硫渣(主要成分为Fe、CaO及少量MgO、Al2O3、SiO2)为原料,制备高纯度硫酸亚铁晶体的流程如下:
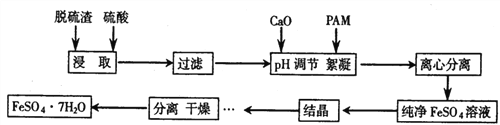
(1)在结晶过程中,pH、温度对硫酸亚铁纯度的影响如图1、图2,则蒸发结晶时适宜的条件为_____。
(2)离心分离后在30℃下干燥6h后得高纯度硫酸亚铁晶体,30℃下干燥其原因可能是______。
(3)实验室进行过滤操作时所需用到的玻璃仪器有_______。
(4)硫酸亚铁晶体可用来净化硫酸亚铁晶体可用来净化含K2Cr2O7废水,取一定质量的FeSO4·7H2O 和足量的KOH溶液加入到含K2Cr2O7废水中可得到一定量的磁性材料Cr0.5Fe1.5FeO4,处理含5.00×10-3mol K2Cr2O7的废水,需要多少克的FeSO4·7H2O(写出计算过程)。_______________
【答案】 pH=2、70℃下蒸发结晶 高于30℃晶体易失去结晶水 烧杯、玻璃棒、漏斗 13.9g
【解析】(1)根据图示可知,当pH=2时,硫酸亚铁的纯度最大;当温度为70℃时,硫酸亚铁的纯度最大;正确答案:pH=2、 70℃下蒸发结晶 。
(2)硫酸亚铁晶体中含有结晶水,温度高于30℃,晶体易失去结晶水,正确答案:高于30℃晶体易失去结晶水。
(3)实验室进行过滤操作时所需用到的玻璃仪器有烧杯、玻璃棒、漏斗,正确答案:烧杯、玻璃棒、漏斗。
(4)设处理处理含5.00×10-3mol K2Cr2O7的废水,需要FeSO4·7H2O的物质的量为xmol,根据信息可知:
10 FeSO4+18KOH+ K2Cr2O7=10K2SO4+4 Cr0.5Fe1.5FeO4+9H2O
10 1
x 5.00×10-3
解之得x= 5.00×10-2mol,所以需要绿矾物质的量为5.00×10-2mol,所以需要FeSO4·7H2O的质量为5.00×10-2×278=13.9g,正确答案:13.9 g。


科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
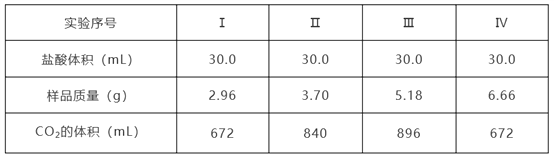
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2)盐酸的物质的量浓度c(HCl)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】373K时,某 1L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)![]() N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
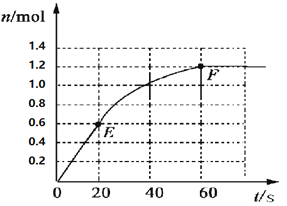
(1)前20 s内NH3(g)的平均反应速率为___________;
(2)373K时该反应的平衡常数的值为______________;
(3)若在此平衡体系中再加入1mol的NH3,与原平衡比较,新平衡时NH3的转化率______(填“增大”或“减小”,下同),NH3的平衡浓度_________。
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为_________(填“放热反应”或“吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)______。
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的____________________性。
②误食重金属盐会使人中毒,应口服_______________来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了___________________(化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是_____________。

(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是______________。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是___________(填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式__________。青椒、西红柿等蔬菜富含维生素C,维生素C 又称____________酸,用淀粉溶液和碘水可检验维生素C的_________性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的__________(填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式____________________________________。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式__________。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )

A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A. 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>①
B. pH=2 的H2C2O4溶液与pH=12 的NaOH 溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C. 向0.2mo/L 的NaHCO3 溶液中加入等体积0.1mo/L 的NaOH 溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,等浓度的CH3COOH与CH3COONa 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。

(1)装置B、C中应盛放的试剂名称分别为__________、_________;从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是___________________________。
(2)实验时,先点燃A处的酒精灯,让氯气充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:______________________。
(3)F装置所起的作用是____________________,____________________。
(4)用石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式: _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,其中电极Ⅰ为Al,其它均为Cu,下列说法正确的是
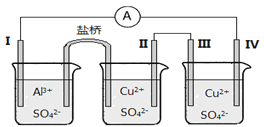
A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极Ⅱ逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com