
����Ŀ��373Kʱ��ij 1L�ܱ������м���2mol NH3�������¿��淴Ӧ��2NH3��g��![]() N2��g��+3H2��g������������H2�����ʵ����仯����ͼ��ʾ��
N2��g��+3H2��g������������H2�����ʵ����仯����ͼ��ʾ��
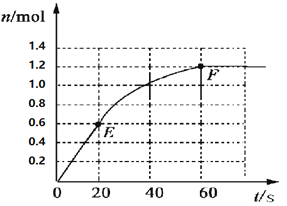
��1��ǰ20 s��NH3��g����ƽ����Ӧ����Ϊ___________��
��2��373Kʱ�÷�Ӧ��ƽ�ⳣ����ֵΪ______________��
��3�����ڴ�ƽ����ϵ���ټ���1mol��NH3����ԭƽ��Ƚϣ���ƽ��ʱNH3��ת����______�������С������ͬ����NH3��ƽ��Ũ��_________��
��4����ԭƽ��������473K�����´�ƽ��ʱ�������������䣩��H2��ƽ��Ũ��ΪNH3��2�����÷�Ӧ������ӦΪ_________������ȷ�Ӧ�������ȷ�Ӧ������Ϊ����ƽ����ϵ��H2�����ʵ��������д�ʩ��ȷ���ǣ�����������ͬ��______��
a�������¶� b��������������� c��������ʵĴ��� d���ٳ���N2
���𰸡� 0��02mol/(L��s) 0.48 ��С ���� ���ȷ�Ӧ ab
����������1��ǰ20 s���������ʵ����仯��Ϊ0.6mol�������ı仯��Ϊ0.4mol��Ũ����0.4mol/L����20 s��NH3��g����ƽ����Ӧ����Ϊ0.4mol/L��20s��0.02mol/(L��s)��
��2��ƽ��ʱ���������ʵ�����1.2mol������ݷ���ʽ��֪
2NH3��g��![]() N2��g��+3H2��g��
N2��g��+3H2��g��
��ʼŨ�ȣ�mol/L�� 2 0 0
ת��Ũ�ȣ�mol/L�� 0.8 0.4 1.2
ƽ��Ũ�ȣ�mol/L�� 1.2 0.4 1.2
����ƽ�ⳣ��K��![]()
��3����Ӧ��ֻ��һ�֣�ƽ��ʱ���백���൱��������ϵѹǿ������ѹǿ��ƽ��������У�����ת���ʼ�С������ƽ��Ũ������
��4����ԭƽ��������473K�����´�ƽ��ʱ�������������䣩��H2��ƽ��Ũ��ΪNH3��2����˵��ƽ��������Ӧ�����ƶ�������Ӧ�����ȷ�Ӧ��Ϊ����ƽ����ϵ��H2�����ʵ�������ʹƽ�������ƶ���a�������¶�ƽ��������Ӧ������У�a��ȷ��b���������������ѹǿ��С��ƽ��������Ӧ������У�b��ȷ��c��������ʵĴ���ƽ�ⲻ�ƶ���c����d���ٳ���N2ƽ�����淴Ӧ������У�����Ũ�ȼ�С��d����ѡab��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��һ����Ҫ�Ļ���ԭ������֪A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��B�ɷ���������Ӧ������֮���ת����ϵ��ͼ��
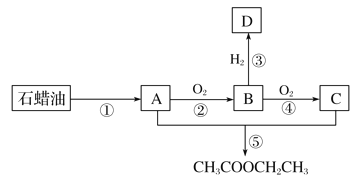
��ش���
(1)�л���B�к��еĹ�����������_______________________________________________��
(2)�����������ӳɷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��_________________________________��
(3)�����������л���D��Ӧ���õ�������������ˮ���μ�2�η�̪��Һ��ˮ��Һ�Ժ�ɫ����ԭ����__________________(�û�ѧ����ʽ��ʾ)��
(4)����˵����ȷ����________��
A���л���A��D��һ�������¿ɷ�Ӧ��������[(CH3CH2)2O]
B�������Ƽ���������ͭ����Һ�������л���B��C��D
C��ͨ��ֱ�����������������л���C�Ļ�������ɷ���õ�������������
D����ͬ��������������������������Һ��ˮ�����ϡ�����и���ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ֻ�����Ӧ���ͣ�������������ԭ��Ӧ���ǣ� ��
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl��+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CeO2)��һ����Ҫ��ϡ��������Է�̼���(��Ҫ��CeCO3F)Ϊԭ���Ʊ�CeO2��һ�ֹ����������£�
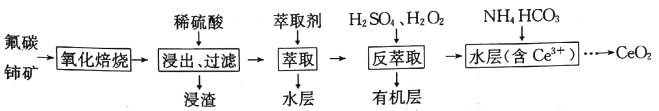 ��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��.��������ϵ��Ce4+�ܱ���ȡ��[(HA)2]��ȡ����Ce3+����
��.�����£�Ce2(CO3)3������ҺŨ��Ϊ1.0��10-6mol��L-1��
�ش��������⣺
��1�������������������п��Լӿ췴Ӧ���ʺ����ԭ�������ʵķ�����__________��__________ (д��2�ּ���)��
��2��д������������������CeO2��ϡH2SO4��Ӧ�����ӷ���ʽ��__________��
��3������ȡ��ʱ���ڷ�Ӧ��Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=
Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=![]() )�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
)�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
��4�������������ɵ�Ce(BF4)3������KCl��Һ�������·�Ӧ��
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)��
3KBF4(s)+ Ce3+(aq)��
��һ���¶�ʱ��Ce(BF4)3��KBF4��Ksp�ֱ�Ϊa��b����÷�Ӧ��ƽ�ⳣ��K=__________(��a��b��ʾ)��
��5��������ȡ���м�H2O2����Ҫ��Ӧ���ӷ���ʽΪ__________����������ȡ��������ˮ���м���1.0mol��L-1��NH4HCO3��Һ������Ce2(CO3)3��������Ce3+������ȫʱ[c(Ce3+)=1��10-5mol��L-1]����Һ��c(CO32-)ԼΪ__________��
��6��CeO2������β�����������Ĺؼ��ɷ֣������ڻ�ԭ�����й����������������к�������β�����������з�����CeO2![]() CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�飺
����Fe2��SO4��3��CuSO4�Ļ��Һ�м���������ۣ���ַ�Ӧ���к�ɫ�������������ˡ�
��ȡ������Һ�������еμ�KSCN��Һ���۲�����
�ж�����˵����ȷ����
A. ������Cu2+>Fe3+
B. �������ù���ֻ��ͭ
C. ������Һ����Cu2+��Fe2+
D. ���в���۲쵽��Һ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����amol���ۼ��뵽��bmol������Һ�У���ַ�Ӧ��������ȫ�ܽ⣬���ռ���c L���������NO��NO2������塣�����й�˵������ȷ����
A. ����Ӧ�������ֻ��Fe2+���ɣ���![]() < a<
< a<![]()
B. ����Ӧ�������ֻ��Fe3+���ɣ���b=3a +![]()
C. ����Ӧ���������Fe2+��Fe3+���ɣ���![]() <b<6a
<b<6a
D. ����Ӧ����Һ����dmol H+����b=3a+d+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�ڽ���ת¯ǰ����������ʱ�����ķ�����������ij��������������������Ҫ�ɷ�ΪFe��CaO������MgO��Al2O3��SiO2��Ϊԭ�����Ʊ��ߴ��������������������������
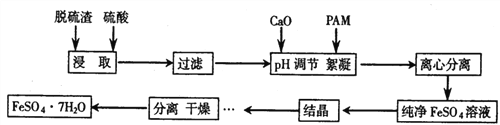
��1���ڽᾧ��������pH���¶ȶ������������ȵ�Ӱ����ͼ1��ͼ2���������ᾧʱ���˵�����Ϊ_____��
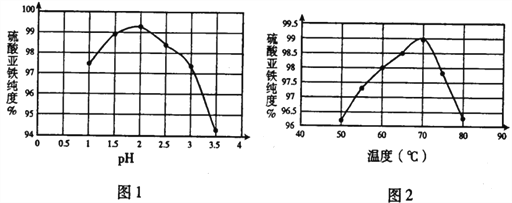
��2�����ķ������30���¸���6h��øߴ��������������壬30���¸�����ԭ�������______��
��3��ʵ���ҽ��й��˲���ʱ�����õ��IJ���������_______��
��4����������������������������������������������K2Cr2O7��ˮ��ȡһ��������FeSO4��7H2O ��������KOH��Һ���뵽��K2Cr2O7��ˮ�пɵõ�һ�����Ĵ��Բ���Cr0.5Fe1.5FeO4��������5.00��10-3mol K2Cr2O7�ķ�ˮ����Ҫ���ٿ˵�FeSO4��7H2O��д��������̣���_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵ�ԭ������������������AԪ��ԭ�ӵĺ���p��������s��������1��C�ǵ縺������Ԫ�ء�Dԭ�Ӵ���������������������2����E�ǵ�������ԭ��������С��Ԫ�ء�
��1��д����̬Cԭ�ӵĵ����Ų�ʽ_________________��
��2��A��B����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________(��Ԫ�ط��ű�ʾ)��ԭ����___________________��
��3����֪DC4������Ϊ���壬������ʵľ���������_________�������������ԭ�ӵĹ���ӻ�����Ϊ____________���ռ乹����___________��
��4��Cu2��������AH3�γ�������[Cu(AH3)4]2������AC3������Cu2���γ������ӣ���ԭ����______________________��
��5��A��B��Ԫ�طֱ���D�γɵĹ��ۼ��У����Խ�ǿ����__________��A��B��Ԫ�ؼ����γɶ��ֶ�Ԫ�����������A3����Ϊ�ȵ���������ʵĻ�ѧʽΪ__________��
��6����֪E���ʵľ�����ͼ��ʾ��������Eԭ�ӵ���λ��Ϊ__________��һ��E�ľ�������Ϊ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȫ���ҵIJ���ҩ����Ҫ����NaN3��Fe2O3��KClO4��NaHCO3�����ʡ�������������ײʱ������ҩ��������������ʹ����Ѹ�����ͣ��Ӷ��������á�
(1)Fe2O3��������������Na�����û���Ӧ���ɵĻ�ԭ����Ϊ________(�ѧʽ)��
(2)KClO4���������������к��л�ѧ��������Ϊ________________________��
(3)NaHCO3����ȴ�������ղ����������ͷŵ������������ֽ⣬�仯ѧ����ʽΪ
________________________________________________________________��
(4)NaN3�����巢���������ȷֽ����N2��Na��ȡ56 g��������ҩ�����ֽ����������ͨ����ʯ�Һ�����Ϊ16.8 L(��״��)���ò���ҩ����NaN3����������Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com