
【题目】将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是
A. 若反应后产物中只有Fe2+生成,则![]() < a<
< a<![]()
B. 若反应后产物中只有Fe3+生成,则b=3a +![]()
C. 若反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a
<b<6a
D. 若反应后溶液中有dmol H+,则b=3a+d+![]()
【答案】B
【解析】当反应后产物中只有Fe2+生成,且产生的气体只有NO时,根据电子守恒规律:2a=3c/22.4,得 a=3c/44.8,当反应后产物中只有Fe2+生成,且产生的气体只有NO2时,根据电子守恒规律:2a=c/22.4,得a= c/44.8,所以,在收集c L(标况)的NO、NO2混合气体时,则![]() < a<
< a<![]() ,A正确;若反应后产物中只有Fe3+生成,硝酸恰好完全反应,根据氮原子守恒:3 a+ c/22.4=b,若硝酸过量,b >3 a+ c/22.4,B错误;如果反应为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据3Fe---8HNO3关系,可知b=8a/3,当反应只发生:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O,根据Fe+6HNO3关系可知:b=6a ,所以,当反应后产物中有Fe2+、Fe3+生成,则
,A正确;若反应后产物中只有Fe3+生成,硝酸恰好完全反应,根据氮原子守恒:3 a+ c/22.4=b,若硝酸过量,b >3 a+ c/22.4,B错误;如果反应为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据3Fe---8HNO3关系,可知b=8a/3,当反应只发生:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O,根据Fe+6HNO3关系可知:b=6a ,所以,当反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a,C正确;反应后溶液中有dmol H+,说明硝酸过量,一定生成硝酸铁,根据氮原子守恒规律:b=3a+d+
<b<6a,C正确;反应后溶液中有dmol H+,说明硝酸过量,一定生成硝酸铁,根据氮原子守恒规律:b=3a+d+![]() ,D正确;正确选项B。
,D正确;正确选项B。


科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钠、镁、铝、铁四种金属单质中的两种组成的合金共24g,跟足量的盐酸反应产生11.2L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体歩驟如下:
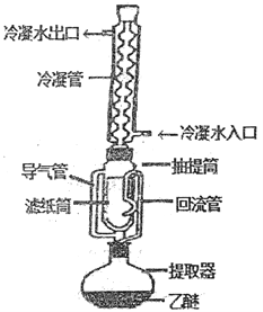
①包装:取滤纸制成滤纸管,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,貭量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,貭量记作b.
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水.加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h).
③称量.萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温.然后放入称量瓶中称量,貭量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称________。为提高乙醚蒸气的冷凝效果,索氏提取器中的冷凝管可选用下列(______)
A.空气冷凝管![]()
B.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为____(填字母)。
A.活性炭 B.碱石灰 C.P2O5 D.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是__________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提管中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为______。
(4)数据处理:样品中纯脂肪百分含量____(填“>”、“<”或“=”)![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】373K时,某 1L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)![]() N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
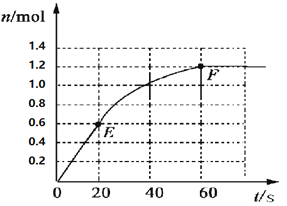
(1)前20 s内NH3(g)的平均反应速率为___________;
(2)373K时该反应的平衡常数的值为______________;
(3)若在此平衡体系中再加入1mol的NH3,与原平衡比较,新平衡时NH3的转化率______(填“增大”或“减小”,下同),NH3的平衡浓度_________。
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为_________(填“放热反应”或“吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)______。
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
(1)罐壁内凹而瘪的原因是_________________________________________,
离子方程式可能为_______________________________________________;
(2)罐再鼓起的原因是________________________________________,
离子方程式可能为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )

A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为进行某些实验的探究,某兴趣小组设计了如下装置。

(1)为探究浓硫酸与木炭反应的全部产物,分液漏斗中盛浓硫酸,圆底烧瓶中放木炭。
①装置B中试剂的名称是________。
②装置C、D、E中所盛放的试剂分别是品红、酸性KMnO4溶液和澄清的石灰水。C装置的作用是________,确认产物中含有CO2的实验现象是________。
(2)为了制取无水氯化铜,上述装置中的分液漏斗中盛浓盐酸,圆底烧瓶中放MnO2,B中放铜粉并在玻璃管下添加酒精灯,且将B装置平移至D与E之间。
①此时C、D中依次加入的试剂分别是________。
②若E中为NaOH溶液用于尾气吸收,常温下发生反应的离子方程式为________。
③实验结束时,应首先熄灭装置B下面的酒精灯,其目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com