
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体歩驟如下:
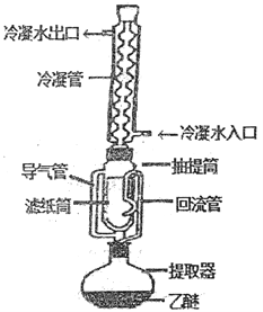
①包装:取滤纸制成滤纸管,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,貭量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,貭量记作b.
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水.加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h).
③称量.萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温.然后放入称量瓶中称量,貭量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称________。为提高乙醚蒸气的冷凝效果,索氏提取器中的冷凝管可选用下列(______)
A.空气冷凝管![]()
B.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为____(填字母)。
A.活性炭 B.碱石灰 C.P2O5 D.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是__________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提管中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为______。
(4)数据处理:样品中纯脂肪百分含量____(填“>”、“<”或“=”)![]() 。
。
【答案】 干燥器 C A 取少量乙醚滴加稀硫酸和KI淀粉溶液,撤荡,若溶液变蓝色,则说明含有过氧化物,否则不含 水浴加热 B 连续、反复、多次萃取、且每一次萃取都是纯的溶剂,萃取效率高 <
【解析】(1)根据“移至仪器X中冷却至室温”判断;根据仪器构造结合提高冷凝效果判断;
(2)①根据物质的性质特点分析;
②根据过氧化物具有强氧化性分析;
(3)①根据水浴加热容易控制温度解答;
②根据虹吸是利用液面高度差的作用力现象解答;
③根据二者的萃取原理分析;
(4)根据乙醚可能溶解样品中的其它有机物分析。
(1)题中三次描述“移至仪器X中冷却至室温”,说明仪器X是干燥器;为提高乙醚蒸气的冷凝效果,索氏提取器中的冷凝管可选用C蛇形冷凝管,增大接触面积,延长冷凝时间,提高冷凝效果。
(2)①在冷凝管上口连接一个球形干燥管的目的是吸收没有冷凝的乙醚,根据这四种物质的性质,可用来吸收乙醚的只有活性炭,答案选A;
②过氧化物一般都有较强的氧化性,所以可在酸性条件下用KI淀粉来检验,方法是取少量乙醚滴加稀硫酸和KI淀粉溶液,振荡,若溶液变蓝色则说明含过氧化物,否则不含。
(3)①根据需要控制的温度低于100℃,又不能用明火加热,可进行水浴加热;
②根据实验描述,当萃取液的液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中,这是利用虹吸原理,答案选B;
③根据题干信息可知索氏提取法与一般萃取法相比较,其优点为可进行连续、反复、多次的萃取,且每一次萃取都是用纯的溶剂,萃取效率高。
(4)由于有机溶剂乙醚可能溶解样品中的其它有机物,所以纯脂肪的质量小于(b-c)g,因此样品中纯脂肪百分含量小于![]() 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:

已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: Fe2O3+2Al![]() Al2O3+2Fe,回答下列问题:
Al2O3+2Fe,回答下列问题:
(1)在该反应中____元素的化合价升高,该元素的原子_____电子,被____;
(2)在该反应中______元素的化合价降低,该元素的原子________电子,被________。
(3)该反应中,Fe2O3发生了________反应,Al发生了________反应。
(4)_______是氧化剂,_______是还原剂,_______是氧化产物,_______是还原产物。
(5)用单线桥标出电子转移的方向和数目______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
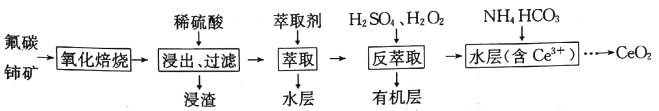 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3
(1)25℃时,0.1mol·L-1①溶液呈______性,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温(填“>”、“=”或“<”)下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”),溶液的pH:③_________⑥(填“>”、“=”或“<”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.  C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是
A. 若反应后产物中只有Fe2+生成,则![]() < a<
< a<![]()
B. 若反应后产物中只有Fe3+生成,则b=3a +![]()
C. 若反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a
<b<6a
D. 若反应后溶液中有dmol H+,则b=3a+d+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 氢化钙固体登山运动员常用的能源提供剂.某兴趣小组长拟选用如下装置制备氢化钙.
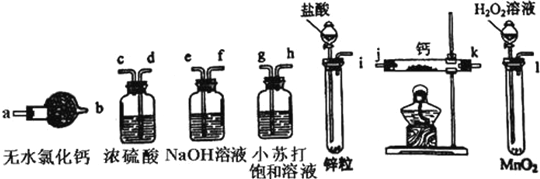
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为__________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)已知钙与氢化钙固体在外观上相似,现设计一个实验,用化学方法区分钙与氢化钙,请完善以下实验的简要步骤及观察到的现象:取适量氢化钙,在加热条件下与 _________反应,将反应气相产物通过装有_______的容器,观察到容器内固体颜色变化为__________;取钙做类似实验,观察不到类似的反应现象.
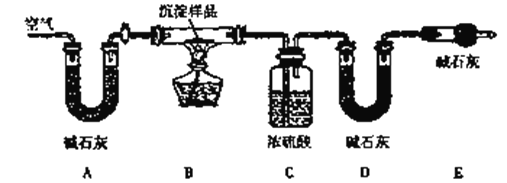
II.某化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀。为此,小组同学对蓝色沉淀成份作了如下探究:
该小组同学利用下列装置通过实验测定其组成
(1)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______________。
(2)若沉淀样品的质量为mg。装置C质量增加了ng,则沉淀中CuCO3的质量分数为_____________。
(3)通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜(化学式CuSO4·3Cu(OH)2)。请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com