
【题目】由钠、镁、铝、铁四种金属单质中的两种组成的合金共24g,跟足量的盐酸反应产生11.2L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Fe
【答案】D
【解析】
根据金属混合物与酸反应时金属失去的电子的物质的量与产生H2时得到电子的物质的量相等分析。
标况下11.2L氢气的物质的量n(H2)=![]() ,转移电子的物质的量为n(e-)=0.5mol×2=1mol。所以金属的平均摩尔电子质量是
,转移电子的物质的量为n(e-)=0.5mol×2=1mol。所以金属的平均摩尔电子质量是![]() ,即平均产生1mol电子需要的金属质量为24g。那么其中一种金属的摩尔电子质量一定大于24g/mol,另一种金属的摩尔电子质量一定小于24g/mol。
,即平均产生1mol电子需要的金属质量为24g。那么其中一种金属的摩尔电子质量一定大于24g/mol,另一种金属的摩尔电子质量一定小于24g/mol。
A. Na在反应中表现+1价,提供1mol电子需要Na的质量为23g÷1mol=23g/mol,
B. Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g÷2mol=12g/mol,
C. Al在反应中表现+3价,提供1mol电子需要Al的质量为27g÷3mol=9g/mol
D. Fe在与酸反应中表现+2价,提供1mol电子需要Fe的质量为56g÷2mol=28gmol,
可见提供1mol电子,只有Fe的质量大于24g,其它金属的质量都小于24g,故金属混合物中一定有Fe,故合理选项为D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示(反应条件及部分产物均已略):
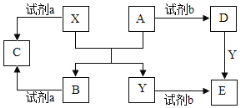
已知:X、Y是生活中常见的金属单质且X具有两性,A、B都是氧化物,A是红棕色粉末。回答下列问题:
(1)A的化学式为______________;
(2)若试剂b是稀硝酸。
①Y的单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式__________________。如果稀硝酸过量,可以选择试剂________进行验证。
②D的阳离子能够与强碱、氯气反应,生成一种高效的净水剂YO42-,写出有关反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Mg、Al分别跟稀盐酸充分反应得到相同质量的氢气,其原因是( )
①Fe、Mg、Al的物质的量相等,盐酸足量;
②Fe、Mg、Al的质量比是56∶24∶27,盐酸足量;
③Fe、Mg、Al的质量比是28∶12∶9,盐酸足量;
④Fe、Mg、Al均过量,所用盐酸的浓度和体积都相同。
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:

已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl↓+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: Fe2O3+2Al![]() Al2O3+2Fe,回答下列问题:
Al2O3+2Fe,回答下列问题:
(1)在该反应中____元素的化合价升高,该元素的原子_____电子,被____;
(2)在该反应中______元素的化合价降低,该元素的原子________电子,被________。
(3)该反应中,Fe2O3发生了________反应,Al发生了________反应。
(4)_______是氧化剂,_______是还原剂,_______是氧化产物,_______是还原产物。
(5)用单线桥标出电子转移的方向和数目______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
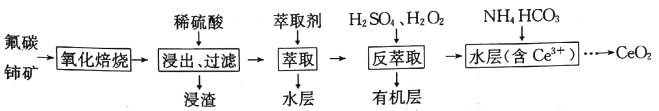 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是
A. 若反应后产物中只有Fe2+生成,则![]() < a<
< a<![]()
B. 若反应后产物中只有Fe3+生成,则b=3a +![]()
C. 若反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a
<b<6a
D. 若反应后溶液中有dmol H+,则b=3a+d+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com