
Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
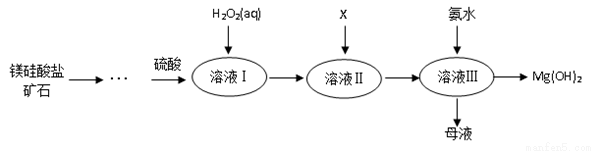
已知:
①溶液Ⅰ中除含Mg2+、SO42?外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
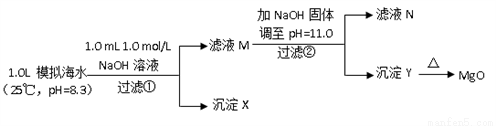
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaO H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
科目:高中化学 来源:2016-2017学年湖北省沙市高一下学期第三次双周考(A卷)化学试卷(解析版) 题型:选择题
下列各组中的性质比较,不正确的是 ( )
A. 稳定性:NH3<PH3<SiH4 B. 酸性:HClO4>H2SO4>H3PO4
C. 碱性:KOH>NaOH>Mg(OH)2 D. 沸点:HF>HI>HBr>HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )
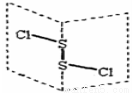
A.S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A. ①③④ B. ①③⑥ C. ③④⑤ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
A. ⅢA族或ⅢB族 B. ⅣA族 C. ⅠB族 D. ⅠA族
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2 2Na2CO3+C。下列叙述错误的是
2Na2CO3+C。下列叙述错误的是
A. 放电时,Na+由负极向正极移动
B. 充电时,阴极反应式为Na++ e—= Na
C. 电解质溶液可选NaClO4水溶液
D. 电池放电时把二氧化碳变废为宝,有重要的研发意义
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:填空题
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c. 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
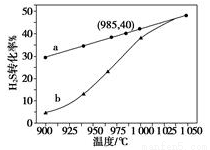
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期第一次月考化学试卷(解析版) 题型:选择题
将足量SO2通入下列溶液中,能产生浑浊的有
①Ba(OH)2溶液 ②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液
A.③④⑤ B.②③⑤ C.①③④⑤ D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com