
| A. | 原CuSO4溶液的浓度为0.1mol/L | |
| B. | 反应过程中共转移0.02mol电子 | |
| C. | 向电解后的溶液中加入适量CuO,可恢复到原溶液 | |
| D. | 阳极周围溶液的pH减小 |
分析 用惰性电极电解1L含CuSO4和KNO3混合溶液,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,依据两极生成气体物质的量结合电解过程中电子守恒计算便可求解.
解答 解:A、用惰性电极电解50mL含CuSO4溶液,在两极均生成标准状况下的气体0.112L,气体的物质的量为0.005mol,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,生成0.005molO2,需电子为4×0.005mol=0.02mol;阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,生成0.005molH2,需0.005mol×2=0.01mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.005mol,所以Cu2+的物质的量浓度c=$\frac{0.005mol}{0.05L}$=0.1mol/L,故A正确;
B、反应过程中共转移0.02mol电子,故B正确;
C、根据出什么加什么的原理,向电解后的溶液中加入适量氢氧化铜,可恢复到原溶液,故C错误;
D、阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,阳极周围溶液的pH减小,故D正确.
故选C.
点评 本题考查了电极原理的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意电子守恒的计算应用和正确书写电极反应,明确电极的放电顺序为解答该题的关键,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
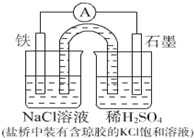
| A. | Fe作正极,发生氧化反应 | |
| B. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| C. | 正极反应:2H++2e-=H2↑ | |
| D. | 工作一段时间后,NaCl溶液中c(Na+ )增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色 | |
| D. | 加入CCl4振荡后,取上层清液,滴加入AgNO3溶液,观察是否有AgCl沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④⑥ | C. | ②④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
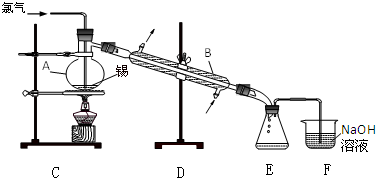
 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com