
【题目】25 ℃时,对于pH=2的CH3COOH溶液,下列判断正确的是( )
A. 加水稀释,电离平衡正向移动,溶液中c(H+)增大,![]() 也增大
也增大
B. 通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka减小
C. 加入少量CH3COONa固体,电离平衡逆向移动,c(H+)减小,Ka不变
D. 升高温度,电离平衡正向移动,c(H+)增大,pH增大
【答案】C
【解析】A项,加水稀释,促进醋酸电离,电离平衡正向移动,但根据化学平衡移动原理(电离平衡也适用),溶液中c(H+)减小, 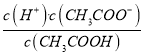 =Ka,温度一定时Ka是常数,故A错误;B项,通入少量HCl气体,c(H+)增大,根据化学平衡移动原理,电离平衡逆向移动,c(CH3COO-)减小,但温度一定时Ka是常数,故B错误;C项,加入少量CH3COONa固体,c(CH3COO-)增大,根据化学平衡移动原理,CH3COOH电离平衡逆向移动,c(H+)减小,因为温度没变,所以Ka不变,故C正确;D项,CH3COOH的电离是吸热过程,升高温度,电离平衡正向移动,c(H+)增大,pH减小,故D错误。
=Ka,温度一定时Ka是常数,故A错误;B项,通入少量HCl气体,c(H+)增大,根据化学平衡移动原理,电离平衡逆向移动,c(CH3COO-)减小,但温度一定时Ka是常数,故B错误;C项,加入少量CH3COONa固体,c(CH3COO-)增大,根据化学平衡移动原理,CH3COOH电离平衡逆向移动,c(H+)减小,因为温度没变,所以Ka不变,故C正确;D项,CH3COOH的电离是吸热过程,升高温度,电离平衡正向移动,c(H+)增大,pH减小,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的( )
A. 次氯酸钠溶液中通入少量二氧化硫气体:2ClO﹣+SO2+H2O═2HClO+SO ![]()
B. 向NaAlO2溶液中通过量CO2:AlO ![]() +CO2+H2O═Al(OH)3↓+CO
+CO2+H2O═Al(OH)3↓+CO ![]()
C. 电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+
D. 小苏打溶液与NaOH溶液混合:HCO ![]() +OH﹣═CO2↑+H2O
+OH﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2广泛应用于医疗卫生、化学合成等领域。
(1)H2O2的电子式是___________。
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii_______________(用热化学方程式表示)。
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是________。
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。_________

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L NaCl | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4 和2滴1mol/L NaCl | 2滴1mol/L CuSO4 和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
实验Ⅰ的目的是______________,由实验(3)可得出的结论是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1mol的H2的体积为22.4LB.0.012kgC-12含有的原子数就是阿伏伽德罗常数
C.17gNH3中含有的电子数为10D.N2和CO的摩尔质量相等,都是28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )

A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)煤的气化是将其转化为可燃性气体的过程,主要化学反应方程式为__________。煤也可以直接液化,属于________________(填“化学变化”或“物理变化”)。
(2)由乙烯合成聚乙烯的化学方程式为_______________该高分子化合物的链节为___;若该高分子化合物的相对分子质量为42 000,则其聚合度为__。
(3)一种甲烷水合物晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均组成可表示为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com