
【题目】H2O2广泛应用于医疗卫生、化学合成等领域。
(1)H2O2的电子式是___________。
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii_______________(用热化学方程式表示)。
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是________。
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。_________

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L NaCl | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4 和2滴1mol/L NaCl | 2滴1mol/L CuSO4 和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
实验Ⅰ的目的是______________,由实验(3)可得出的结论是________________。
【答案】 ![]() H2O2(l) + IO-(aq) ==== H2O(l) + O2(g) + I-(aq) H= -(196+a)kJ/moL H2O2的分解反应速率与c(H2O2)和c(I-)成正比或答:在其它条件不变时,催化剂的浓度[或c(I-)]越大,H2O2的分解速率越大,c(I-)不变时,H2O2浓度越大,分解速率越大
H2O2(l) + IO-(aq) ==== H2O(l) + O2(g) + I-(aq) H= -(196+a)kJ/moL H2O2的分解反应速率与c(H2O2)和c(I-)成正比或答:在其它条件不变时,催化剂的浓度[或c(I-)]越大,H2O2的分解速率越大,c(I-)不变时,H2O2浓度越大,分解速率越大 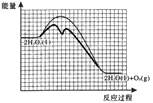 对比实验,证明NaCl对H2O2分解没有催化作用 NaCl对H2O2分解没有催化作用,CuSO4对H2O2分解有催化作用,NaCl在CuSO4存在时对H2O2分解有催化作用,且NaCl浓度越大催化效果越强
对比实验,证明NaCl对H2O2分解没有催化作用 NaCl对H2O2分解没有催化作用,CuSO4对H2O2分解有催化作用,NaCl在CuSO4存在时对H2O2分解有催化作用,且NaCl浓度越大催化效果越强
【解析】(1)H2O2的电子式是![]() ;(2)①根据反应的机理可知,总反应a:2H2O2(l)=2H2O(l)+O2(g) △Ha=-196kJ/mol, i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0),根据盖斯定律,由a-i得反应ii.H2O2(l)+ IO-(aq) ==== H2O(l) + O2(g) + I-(aq) H=△Ha - △H1=-(196+a)kJ/moL;② 根据图中信息可知,H2O2的分解反应速率与c(H2O2)和c(I-)成正比或在其它条件不变时,催化剂的浓度[或c(I-)]越大,H2O2的分解速率越大,c(I-)不变时,H2O2浓度越大,分解速率越大;③ 催化剂只改变化学反应速率而不能使平衡移动,也不能改变焓变,则 “反应过程—能量”示意图为:
;(2)①根据反应的机理可知,总反应a:2H2O2(l)=2H2O(l)+O2(g) △Ha=-196kJ/mol, i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0),根据盖斯定律,由a-i得反应ii.H2O2(l)+ IO-(aq) ==== H2O(l) + O2(g) + I-(aq) H=△Ha - △H1=-(196+a)kJ/moL;② 根据图中信息可知,H2O2的分解反应速率与c(H2O2)和c(I-)成正比或在其它条件不变时,催化剂的浓度[或c(I-)]越大,H2O2的分解速率越大,c(I-)不变时,H2O2浓度越大,分解速率越大;③ 催化剂只改变化学反应速率而不能使平衡移动,也不能改变焓变,则 “反应过程—能量”示意图为: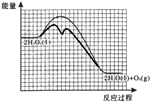 ;(3)实验Ⅰ的目的是对比实验,证明NaCl对H2O2分解没有催化作用;通过表中数据,由实验(3)可得出的结论是NaCl对H2O2分解没有催化作用,CuSO4对H2O2分解有催化作用,NaCl在CuSO4存在时对H2O2分解有催化作用,且NaCl浓度越大催化效果越强。
;(3)实验Ⅰ的目的是对比实验,证明NaCl对H2O2分解没有催化作用;通过表中数据,由实验(3)可得出的结论是NaCl对H2O2分解没有催化作用,CuSO4对H2O2分解有催化作用,NaCl在CuSO4存在时对H2O2分解有催化作用,且NaCl浓度越大催化效果越强。


科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L 氨水溶液中逐滴加入等浓度的HCl溶液,溶液中pOH [pOH=-lgc(OH)]与pH 的变化关系如图所示,则下列说法错误的是
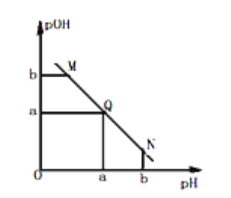
A. M 点和N 点所示溶液中水的电离程度相同
B. M点所示溶液导电能力弱于Q点
C. Q点消耗盐酸溶液的体积等于氨水溶液的体积
D. M 点所示溶液中c(NH4+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯在一定条件下,可生产二甲苯的混合物和苯。有关物质的沸点、熔点如下:
对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
沸点/℃ |
|
|
|
|
熔点/℃ |
|
|
|
|
下列说法不正确的是
A. 甲苯生成二甲苯混合物和苯的反应属于取代反应
B. 甲苯的沸点高于![]() ℃
℃
C. 用蒸馏的方法可将苯从反应所得产物中首先分离出来
D. 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学(选修模块)乙酸苯甲酯是制造香精的原料之一,其合成路线如下:
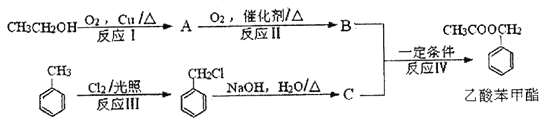
(1)乙酸苯甲酯的分子式为____________,反应Ⅰ的反应类型为____________。
(2)A的结构简式为_____________,B中含有的官能团的名称为______________。
(3)反应Ⅲ的化学方程式为_________________________________。
(4)![]() 不能发生的化学反应是___________(填序号)。
不能发生的化学反应是___________(填序号)。
a.取代反应 b.消去反应 c.加成反应
(5)C属于芳香族化合物的同分异构体的结构简式为___________(写出一种即可)。
(6)反应Ⅳ的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在济液中能大量共存的是
A. Na+、OH-、S2O32-、Cl- B. Fe3+、K+、,AlO2-、HCO3-
C. H+、Al3+、CO32-、SO42- D. H+、Na+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究浓硝酸的性质。
Ⅰ.木炭与浓硝酸反应:
(1)甲同学设计了图1装置,认为若有红棕色气体产生就说明木炭与浓硝酸发生了反应。写出木炭与浓硝酸反应的化学方程式________________________。
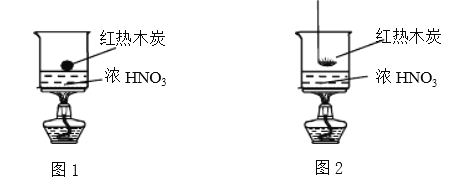
(2)乙同学认为红棕色气体不能作为木炭与浓硝酸反应的证据,其理由是____。
(3)乙同学设计了图2装置实验,木炭能燃烧,并产生红棕色气体。针对该实验现象,乙同学做出如下假设:
假设a:_____________________________;
假设b:红热木炭使HNO3分解产生NO2,NO2可能具有助燃性,木炭燃烧;
假设c:红热木炭使HNO3分解产生O2,木炭与O2反应燃烧;
假设d:红热木炭使HNO3分解产生NO2和O2,共同影响木炭的燃烧;
……
(4)设计实验证明假设b成立,请将实验方案补充完整。
①实验方法:_________________。
实验现象:木炭在该气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
②根据实验现象写出木炭与此气体反应的化学方程式________________。
Ⅱ.设计硝酸在不同条件下分解实验,方案见下表:
装置 |
|
|
|
操作 及 现象 | 先点燃ⅰ处酒精灯,溶液沸腾后没有观察到红棕色气体产生。然后撤走ⅰ处酒精灯,点燃ⅱ处酒精灯并加热试管中部,很快看到大量红棕色气体产生 | 光照8小时,溶液不变黄 | 光照几分钟后看到液面上方出现红棕色,溶液变黄 |
(5)分析上述现象,得出使硝酸成功分解的关键是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或数据正确的是( )
A. 用广泛pH试纸测得某溶液的pH为2.3
B. 酸碱中和滴定实验中,锥形瓶必须用待测液润洗
C. 用已知浓度的盐酸滴定未知浓度的NaOH溶液时,若读取标准液读数时,滴前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,对于pH=2的CH3COOH溶液,下列判断正确的是( )
A. 加水稀释,电离平衡正向移动,溶液中c(H+)增大,![]() 也增大
也增大
B. 通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka减小
C. 加入少量CH3COONa固体,电离平衡逆向移动,c(H+)减小,Ka不变
D. 升高温度,电离平衡正向移动,c(H+)增大,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
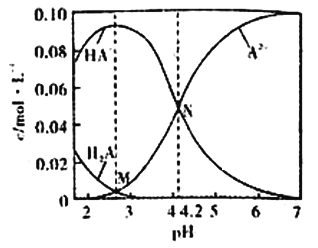
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com