
【题目】某温度下,向一定体积0.1mol/L 氨水溶液中逐滴加入等浓度的HCl溶液,溶液中pOH [pOH=-lgc(OH)]与pH 的变化关系如图所示,则下列说法错误的是
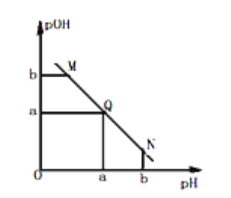
A. M 点和N 点所示溶液中水的电离程度相同
B. M点所示溶液导电能力弱于Q点
C. Q点消耗盐酸溶液的体积等于氨水溶液的体积
D. M 点所示溶液中c(NH4+) > c(OH-)
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm之间的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散入蒸馏水中,得到的物质()
①是溶液 ②是胶体 ③具有丁达尔效应 ④能透过滤纸 ⑤静置会立即形成沉淀
A.②③④B.②③⑤C.①④⑤D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离的c(H+)=1×10-13 mol/L,该溶液可能是 ( )
①二氧化硫水溶液 ②氯化铵水溶液 ③碳酸钠水溶液 ④氢氧化钠水溶液
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的( )
A. 次氯酸钠溶液中通入少量二氧化硫气体:2ClO﹣+SO2+H2O═2HClO+SO ![]()
B. 向NaAlO2溶液中通过量CO2:AlO ![]() +CO2+H2O═Al(OH)3↓+CO
+CO2+H2O═Al(OH)3↓+CO ![]()
C. 电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+
D. 小苏打溶液与NaOH溶液混合:HCO ![]() +OH﹣═CO2↑+H2O
+OH﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2广泛应用于医疗卫生、化学合成等领域。
(1)H2O2的电子式是___________。
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii_______________(用热化学方程式表示)。
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是________。
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。_________

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L NaCl | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4 和2滴1mol/L NaCl | 2滴1mol/L CuSO4 和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
实验Ⅰ的目的是______________,由实验(3)可得出的结论是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com