
【题目】常温下,某溶液中由水电离的c(H+)=1×10-13 mol/L,该溶液可能是 ( )
①二氧化硫水溶液 ②氯化铵水溶液 ③碳酸钠水溶液 ④氢氧化钠水溶液
A. ①② B. ②③ C. ①④ D. ③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。

几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为________,滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是_________。“调节pH”除去的离子主要有Al3+和_________。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是___________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 ![]() Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为____________。
(6)工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。

①电解槽中阳极的电极反应式是__________________。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO,稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L 氨水溶液中逐滴加入等浓度的HCl溶液,溶液中pOH [pOH=-lgc(OH)]与pH 的变化关系如图所示,则下列说法错误的是
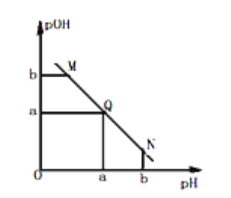
A. M 点和N 点所示溶液中水的电离程度相同
B. M点所示溶液导电能力弱于Q点
C. Q点消耗盐酸溶液的体积等于氨水溶液的体积
D. M 点所示溶液中c(NH4+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1mo/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为____________
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为_________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤: “操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4·7H2O为17.22g,则MgSO4·7H2O的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是 ( )
A. H2SO4 B. CuSO4 C. CH3COONa D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在济液中能大量共存的是
A. Na+、OH-、S2O32-、Cl- B. Fe3+、K+、,AlO2-、HCO3-
C. H+、Al3+、CO32-、SO42- D. H+、Na+、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com