
【题目】某小组设计如图装置,利用氢镍电池为钠硫电池(总反应为:![]() )充电。已知氢镍电池放电时的总反应式为
)充电。已知氢镍电池放电时的总反应式为![]() ,其中M为储氢合金,下列说法正确的是
,其中M为储氢合金,下列说法正确的是

A. a极为氢镍电池的正极
B. 充电时,![]() 通过固体
通过固体![]() 陶瓷向M极移动
陶瓷向M极移动
C. 氢镍电池的负极反应式为![]()
D. 充电时,外电路中每通过2mol电子,N极上生成1molS单质
【答案】B
【解析】
由电池总反应可知,氢镍电池放电时为原电池反应,负极反应式为MH+OH--e-=M+H2O,正极反应式为NiOOH+e-+ H2O =Ni(OH)2+OH-;钠硫电池充电时为电解池反应,阴极反应式为
2Na++ 2e-=2Na,阳极反应式为Sx2--2e-=xS;充电时,两个电池的电极负接负,正接正,固体Al2O3中的Na+(阳离子)向阴极(电池的负极)移动,据此解答。
A.根据以上分析,与a极相连的是钠硫电池的负极,所以a极为氢镍电池的负极,故A错误;
B. 电解时阳离子向阴极移动,所以充电时,![]() 通过固体Al2O3陶瓷向M极移动,故B正确;
通过固体Al2O3陶瓷向M极移动,故B正确;
C. 氢镍电池的负极发生氧化反应,反应式为MH+OH--e-=M+H2O,故C错误;
D. 充电时,N电极为阳极,反应式为Sx2--2e-=xS,根据电子守恒,外电路中每通过2mol电子,N极上生成xmolS单质,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】下列有关原子结构及元素周期律的叙述不正确的是( )
A. 原子半径:![]() ,离子半径:r(Na+)<r(O2-)
,离子半径:r(Na+)<r(O2-)
B. 第![]() 族元素碘的两种核素
族元素碘的两种核素![]() 和
和![]() 的核外电子数之差为6
的核外电子数之差为6
C. P和As属于第VA族元素,![]() 的酸性强于
的酸性强于![]() 的酸性
的酸性
D. ![]() 、
、![]() 、
、![]() 三种元素最高价氧化物对应水化物的碱性依次减弱
三种元素最高价氧化物对应水化物的碱性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是___;
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是_______;
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)仪器a的名称是_______。
(4)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:____;
(5)C中反应生成BaCO3的化学方程式是_____;
(6)下列各项措施中,不能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体;
b.滴加盐酸不宜过快;
c.在A-B之间增添盛有浓硫酸的洗气装置;
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置。
(7)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3的平均质量为3.94g。则样品中碳酸钙的质量分数为______(保留3位有效数字)。
(8)有人认为不必测定C中生成的BaCO3质量,只要测定装置C吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。你认为按此方法测定是否合适_____(填“是”“否”),若填“否”则结果_____(填“偏低”或“偏高”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手性分子是指在分子结构Cbxay中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
A. 丙氨酸
B. 苹果酸![]()
C. 葡萄糖
D. 甘油醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是
①CH3CH2CH2Br在碱性溶液中水解 ②甲苯在催化剂作用下与Cl2发生苯环上的取代反应 ③2-氯丁烷与NaOH乙醇溶液共热反应 ④ 在催化剂的存在与氢气完全加成 ⑤异戊二烯(
在催化剂的存在与氢气完全加成 ⑤异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
A. ①②③ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是____________(填序号,下同),互为同系物的是______________,互为同分异构体的是________。
①红磷与白磷
②![]() 与
与![]()
③CH3COOCH3与CH3CH2COOCH3
④
⑤
⑥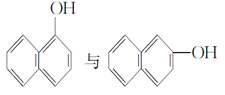
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2: _____________________________________。
② :____________
:____________
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如下所示,请回答下列问题。

①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120 ℃,1.01×105 Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 BaCl2 溶液中通入 SO2 气体,溶液仍然澄清;若将BaCl2 溶液分盛在两支试管中,一只试管加稀HNO3,另一只加NaOH 溶液,然后再通入SO2 气体,结果两支试管都有白色沉淀产生。由此得出的下列结论中不合理的是( )
A.SO2 是酸性氧化物、SO2 具有还原性
B.两支试管中的白色沉淀不是同种物质
C.BaCl2 既能跟强酸、又能跟强碱反应,具有两性
D.加入氢氧化钠溶液,SO2 水溶液中![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。

(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A、蒸馏水B、NaCl固体C、NaCl溶液D、浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com