
【题目】(1)下列各组物质中,互为同位素的是____________(填序号,下同),互为同系物的是______________,互为同分异构体的是________。
①红磷与白磷
②![]() 与
与![]()
③CH3COOCH3与CH3CH2COOCH3
④
⑤
⑥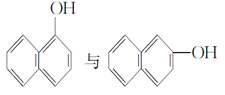
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2: _____________________________________。
② :____________
:____________
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如下所示,请回答下列问题。

①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120 ℃,1.01×105 Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为______________________。
【答案】② ③ ⑥⑦ 2,3-二甲基戊烷 3-甲基-2-氯丁烷 D A A (CH3)2C=C(CH3)2
【解析】
(1)同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;
具有相同分子式而结构不同的化合物互为同分异构体;
同种元素形成的不同单质互为同素异形体;
质子数相同质量数(或中子数)不同的原子互称同位素;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
(2)根据系统命名规则解答;
(3)①1mol烃CxHy的耗氧量为(x+y/4)mol;等质量的上述四种烃,含氢元素的质量越大。
②120℃条件下水为气体,燃烧通式CxHy+(x+y/4)O2 ![]() xCO2+y/2H2O(g),完全燃烧前后气体体积没有变化,则1+(x+y/4)=x+y/2,故y=4,以此判断;
xCO2+y/2H2O(g),完全燃烧前后气体体积没有变化,则1+(x+y/4)=x+y/2,故y=4,以此判断;
③乙烯是平面型结构,根据乙烯的结构确定该物质的结构。
(1)35Cl和37Cl中子数不同,是氯元素的不同核素,互为同位素,故选②;
CH3COOCH3和CH3CH2COOCH3结构相似,相差1个CH2原子团,互为同系物,故选③;
⑥中两种物质分子式相同,结构不同,为官能团位置异构,⑦乙醇与二甲醚,两种物质分子式相同,结构不同,为官能团异构,故属于同分异构的选⑥⑦。
(2)①主链5个碳,2,3号位置有两个甲基, 2,3-二甲基戊烷 ②主链4个碳,3号位置有1个甲基,2号位有氯原子,名称为: 3-甲基-2-氯丁烷;
(3)①1mol烃CxHy的耗氧量为(x+y/4)mol,则等物质的量的CH4、C2H4、C3H8、C6H6中消耗O2最多的是 C6H6,故选D;
等质量的上述四种烃,含氢元素的质量越大,完全燃烧时消耗O2越多,4种物质中CH4的含氢质量最大,等质量时,耗氧量最大,故选A;
②120℃条件下水为气体,燃烧通式CxHy+(x+y/4)O2 ![]() xCO2+y/2H2O(g),完全燃烧前后气体体积没有变化,则1+(x+y/4)=x+y/2,故y=4,即A和C中CH4完全燃烧后体积不变,故选A;
xCO2+y/2H2O(g),完全燃烧前后气体体积没有变化,则1+(x+y/4)=x+y/2,故y=4,即A和C中CH4完全燃烧后体积不变,故选A;
③乙烯是平面型结构,C6H12符合单烯烃的通式,且该烃的所有碳原子都在同一平面上,所以可以看作是乙烯中的氢原子被甲基取代,所以该物质的结构简式为:(CH3)2C=C(CH3)2;


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2。下列有关说法正确的是
①焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g) ΔH1 = 131.3 kJ·mol–1
②太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH2 = 571.6 kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH3 = 206.1 kJ·mol–1
A. 反应①为放热反应
B. 反应②中电能转化为化学能
C. 若反应③使用催化剂,ΔH3不变
D. 反应2H2(g) + O2(g) = 2H2O(g)的ΔH = -571.6 kJ·mol–1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
A.18g![]() 和
和![]() 的混合物中,所含中子数为 10 NA
的混合物中,所含中子数为 10 NA
B.标准状况下,2.24L SO3 中含有的氧原子数目为 0.3 NA
C.物质的量浓度为 0.1molL﹣1 的 MgCl2 溶液中,含有 Cl﹣个数为 0.2 NA
D.一定条件下,2.3g 的金属钠完全与氧气反应时生成 3.6g 产物时失去的电子数为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置,利用氢镍电池为钠硫电池(总反应为:![]() )充电。已知氢镍电池放电时的总反应式为
)充电。已知氢镍电池放电时的总反应式为![]() ,其中M为储氢合金,下列说法正确的是
,其中M为储氢合金,下列说法正确的是

A. a极为氢镍电池的正极
B. 充电时,![]() 通过固体
通过固体![]() 陶瓷向M极移动
陶瓷向M极移动
C. 氢镍电池的负极反应式为![]()
D. 充电时,外电路中每通过2mol电子,N极上生成1molS单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如下所示:
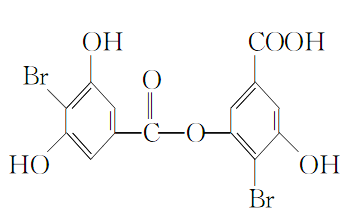
(1)M的分子式为__________。
(2)M分子中含氧官能团的名称为__________。
(3)下列有关M的叙述正确的是________(填字母代号)。
A.在浓硫酸存在时加热可发生消去反应
B.在酸性条件下可发生水解,得到两种不同的有机物
C.可与FeCl3溶液发生显色反应
D.该有机物1 mol与足量氢气充分反应,最多消耗8 mol氢气
(4)请写出M与过量热氢氧化钠溶液反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应X(g)+2Y(g) ![]() 2Z(g) △H= -a kJ·mol—1 , 在一定条件下达到化学平衡时,下列说法正确的是( )
2Z(g) △H= -a kJ·mol—1 , 在一定条件下达到化学平衡时,下列说法正确的是( )
A.反应放出的热量小于a kJ B.c(X)∶c(Y)∶c(Z)=1∶2∶2
C.X的消耗速率与Z的消耗速率相等 D.气体的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)+D(s)。若经2s后测得C的浓度为1.8mol/L,下列说法正确的是
A.2s时物质A的浓度为0.9mol/L
B.用物质D表示的反应速率为0.45mol/(L·s)
C.用物质A表示的反应速率为1.8mol/(L·s)
D.2s时物质B的浓度为1.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现用氯化铜晶体(CuCl2·2H2O,含少量FeCl2杂质)制取纯净的CuCl2·2H2O,先将其制成水溶液,后按如图步骤进行提纯:

已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
Ksp | 2.0×10ˉ20 | 1.0×10ˉ38 | 1.64×10ˉ14 |
请回答下列问题:
①请从下列物质中选出第一步中需加入的X(__________)
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:_____________________________。
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是_______。(通常认为残留在溶液中的离子浓度小于或等于1×10ˉ5 mol/L时就认为沉淀完全)。
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是___________________________________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属Cd作_______极;
②充电时的阳极电极反应式为_____________________________________________。
③充电时,当电路中通过0.2moleˉ,阴极质量将_______(填“增加”、“减少”)___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com