
【题目】(1)现用氯化铜晶体(CuCl2·2H2O,含少量FeCl2杂质)制取纯净的CuCl2·2H2O,先将其制成水溶液,后按如图步骤进行提纯:

已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
Ksp | 2.0×10ˉ20 | 1.0×10ˉ38 | 1.64×10ˉ14 |
请回答下列问题:
①请从下列物质中选出第一步中需加入的X(__________)
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:_____________________________。
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是_______。(通常认为残留在溶液中的离子浓度小于或等于1×10ˉ5 mol/L时就认为沉淀完全)。
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是___________________________________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属Cd作_______极;
②充电时的阳极电极反应式为_____________________________________________。
③充电时,当电路中通过0.2moleˉ,阴极质量将_______(填“增加”、“减少”)___g。
【答案】b 取少量溶液Ⅱ,滴加硫氰化钾溶液,若溶液变成血红色,则证明有Fe3+。 3≤pH<5(不可以等于5) 在HCl气流中蒸发浓缩,冷却结晶 负 Ni(OH)2-e-+ OH-= NiO(OH)+ H2O 减少 3.4
【解析】
(1)①从整个流程分析,加入X是为了将Fe2+氧化成Fe3+,所给四种物质均能实现这一目的,但是NaClO将在溶液中引入Na+杂质,KMnO4将在溶液中引入K+和Mn2+等杂质,HNO3将在溶液中引入NO3-,而且产生的氮的氧化物会引起环境污染,所以选用“绿色”氧化剂H2O2,其还原产物为水。②检验Fe3+,先是取样,然后加KSCN溶液,进行检验。所以答案为:“取少量溶液Ⅱ,滴加硫氰化钾溶液,若溶液变成血红色,则证明有Fe3+”。③调节pH的目的是使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+。Fe3+完全转化为Fe(OH)3沉淀,残留在溶液中的Fe3+浓度小于或等于1×10ˉ5mol/L ,以代入Ksp计算得c(OH-)大于或等于10-11,即3≤pH;根据Cu(OH)2的Ksp,将c(Cu2+)=0.02mol/L代入求得c(OH-)=10-9,所以要控制pH<5;所以控制pH的范围是3≤pH<5;所以答案为:3≤pH<5;④因CuCl2 加热时水解平衡CuCl2+2H2O![]() Cu(OH)2+2HCl会右移,因此在蒸发时要通入HCl气流。所以正确的答案为:在HCl气流中蒸发浓缩,冷却结晶;(2)①放电时,所给式子从左往右看,此时Cd的化合价升高,所以Cd作负极;②充电时,所给式子从右往左看,阳极发生的氧化反应,其对应的电极反应式为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;所以正确答案是:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;③充电时阴极发生反应:Cd(OH)2+2e-=Cd+2OH-,阴极质量要减小,减少的质量即是生成的OH-的质量。此时得电子的物质的量与OH-的物质的量相等,所以生成的OH-的物质的量也是0.2mol,其质量为3.4g。
Cu(OH)2+2HCl会右移,因此在蒸发时要通入HCl气流。所以正确的答案为:在HCl气流中蒸发浓缩,冷却结晶;(2)①放电时,所给式子从左往右看,此时Cd的化合价升高,所以Cd作负极;②充电时,所给式子从右往左看,阳极发生的氧化反应,其对应的电极反应式为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;所以正确答案是:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;③充电时阴极发生反应:Cd(OH)2+2e-=Cd+2OH-,阴极质量要减小,减少的质量即是生成的OH-的质量。此时得电子的物质的量与OH-的物质的量相等,所以生成的OH-的物质的量也是0.2mol,其质量为3.4g。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是____________(填序号,下同),互为同系物的是______________,互为同分异构体的是________。
①红磷与白磷
②![]() 与
与![]()
③CH3COOCH3与CH3CH2COOCH3
④
⑤
⑥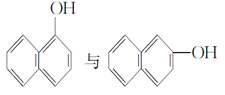
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2: _____________________________________。
② :____________
:____________
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如下所示,请回答下列问题。

①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120 ℃,1.01×105 Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )

A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓释布洛芬是常用的解热镇痛药物,其一种合成路线如下:

已知:① 
② R1COOR2 + R3OH ![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)按照官能团分类,A所属的类别是______。
(2)反应①的化学方程式是______。
(3)试剂X的结构简式是______。
(4)F→G的反应类型是______。
(5)H的结构简式是______。
(6)反应②的化学方程式是______。
(7)缓释布洛芬能缓慢水解释放出布洛芬,请将下列方程式补充完整。
 + 2n H2O
+ 2n H2O![]() ______
______
(8)以丙烯为起始原料制备丙酮酸甲酯(![]() )的合成路线如下,请补充完整(无机试剂任选)。_____
)的合成路线如下,请补充完整(无机试剂任选)。_____
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为________。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为:![]() ,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01mol/L,则此时反应处于___状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
②清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com