
【题目】氧和硫是同主族元素,下列事实不能说明氧的非金属性比硫强的是
A. 酸性:H2S>H2O B. 热稳定性:H2O>H2S
C. 原子半径:S>O D. 化合价:SO2中S为正价
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
A. KSCN溶液和氯水
B. 铁粉和KSCN溶液
C. 浓氨水
D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池已经成为混合动力汽车的主要电池类型。该电池放电时的总反应为:NiOOH + MH==Ni(OH)2 + M,其中M表示储氢合金,MH表示吸附了氢原子的储氢合金,下列说法正确的是
A. 放电时负极反应为:MH+OH--e-==M+H2O
B. 放电时,每转移1mol电子,有1mol NiOOH被氧化
C. 充电时正极反应为:NiOOH+H2O+e-==Ni(OH)2+OH-
D. 电池电解液可用KOH溶液,充电过程中KOH浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2反应得到,化学方程式为
2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH1 K1
NaNO3(s)+ClNO(g) ΔH1 K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3 K3
2ClNO(g) ΔH3 K3
ΔH1 、ΔH2 、ΔH3 之间的关系式为______;平衡常数K1、K2、K3之间的关系式为_______。
(2)已知几种化学键的键能数据如下:
化学键 | NO中的氮氧键 | Cl-Cl键 | Cl-N键 | ClNO中的N=O键 |
键能/(KJ/mol) | 630 | 243 | a | 607 |
则ΔH3+2a=_________。
(3)300℃时,2ClNO(g)![]() 2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
序数 | c(ClNO)/(mol/L) | v/(mol·L·s) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=___________,k=____________。
(4)在两个容积均为2L的恒容密闭容器中分别加入4mol和2mol ClNO,在不同温度下发生反应:2ClNO(g) ![]() 2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。
2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。

①2ClNO(g) ![]() 2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
②A、B两点平衡常数之比为K(A):K(B)=_____。
③B、C两点ClNO的转化率a(B)______a(C) (选填“>”“<”或“=”)。
(5)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) ΔH=-748KJ/mol
2CO2(g)+N2(g) ΔH=-748KJ/mol
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是___________。
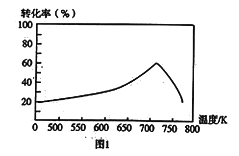
②已知:测定空气中NO和CO含量可用电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______________________;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n (填“>”“<”或“=”)。
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序__________________________________,此时混合溶液___________(填“促进”或“抑制”)水的电离,溶液中c(CH3COOH)+c(CH3COO—)_______0.1mol/L(填“>”“<”或“=”);若保持温度不变,向体积相同、PH=2的盐酸和醋酸溶液分别加等浓度的氢氧化钠溶液至PH=7,盐酸所需氢氧化钠溶液的体积______醋酸所需氢氧化钠溶液的体积(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)

下列推断不正确的是( )
A. 若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其电子式是![]()
D. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提溴和海带提碘都需要经过浓缩、氧化、提取三个步骤。有关叙述错误的是
A. 提溴的浓缩液来自于海水晒盐后的卤水 B. 氧化步骤都可以通入氯气来实现
C. 提取溴时利用溴的挥发性 D. 提取碘时利用碘的升华特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 无论乙烯与丙烯酸(CH2=CH-COOH)以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值
B. 甘油和甲苯无论以和比例混合,充分燃烧后生成水的质量都不变
C. 保存溴水、煤油均不能使用带橡胶塞的试剂瓶,但其原理并不相同
D. 制备环氧乙烷的反应2CH2=CH2+O2![]() 属于加成反应
属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通过软管通入鼠洞中,可以用来消灭田鼠。在此过程中利用了氯气下列性质中的
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤溶于水 ( )
A. ①②③ B. ②③
C. ③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com