
【题目】2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1),下列说法正确的是
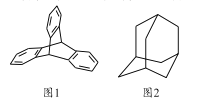
A. 三蝶烯的分子式为C20H16 B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃 D. 三蝶烯和金刚烷的一氯代物均只有一种
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是
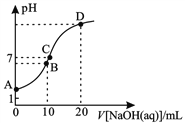
A. A点溶液中加入少量水:![]() 增大
增大
B. B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C. 水电离出来的c(OH -):B点>D点
D. C点:c(Na+) =c(HA-)+2c( A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )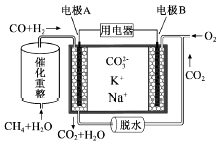
A.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.反应CH4+H2O ![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)
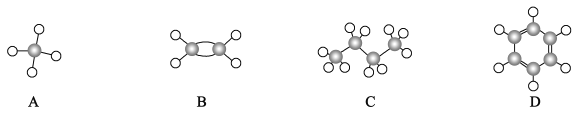
(1)所有原子一定共平面的是______(填序号)
(2)能使酸性高锰酸钾溶液褪色的物质是_____ (填序号)
(3)D与浓硝酸和浓硫酸共热的化学方程式______。
II.某些有机物的转化如下图所示。已知:A是营养物质之一,米饭、馒头中富含A,在酸性条件下水解的最终产物是B。C是白酒的主要成分,D的水溶液能使紫色石蕊试液变红。
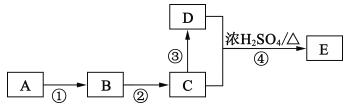
(4)C中官能团的名称为______;反应③的反应类型为______,反应④的化学方程式为______。
(5)反应④中,D断裂的化学键是_______ (填“C一H”、“O一H”或“C一O”)
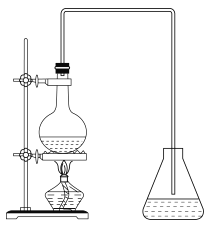
(6)实验室由反应④制备E的装置如图所示。烧瓶中依次加入C、浓硫酸、D和碎瓷片,锥形瓶中加入的是饱和碳酸钠溶液,实验结束后振荡锥形瓶内液体,看到有气泡产生,产生气泡的原因是__________(用离子方程式表示),将锥形瓶中的液体分离的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为几种短周期元素的性质,回答下列问题:
元素编号 | A | B | C | D | E | F | G | H |
原子半径/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
最高或最低化合价 | -2 | +1 | +2 | +3 | +4,-4 | +5,-3 | +7,-1 | +5,-3 |
(1)E元素在元素周期表中的位置是_____;C元素与G元素形成化合物的电子式_____ 。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为_________。
(3)B2A2中含有的化学键为_______,该物质与水反应的化学反应方程式为________。
(4)下列说法不正确的是______(填序号)。
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、D、E、F是原子序数依次增大的六种常见元素。E的单质在Z2中燃烧的产物可使品红溶液褪色。F和Z元素形成的化合物F3Z4具有磁性。X的单质在Z2中燃烧可生成XZ和XZ2两种气体。D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)F元素在周期表中的位置是________,Y的单质分子的结构式为__________,DZ的电子式为________,DZ化合物中离子半径较大的是________(填离子符号)。
(2)X元素形成的同素异形体的晶体类型可能是________(填序号)。
①原子晶体 ②离子晶体 ③金属晶体 ④分子晶体
(3)X、Y、Z形成的10电子氢化物中,X、Y的氢化物沸点较低的是(写化学式):__________;Y、Z的氢化物分子结合H+能力较强的是(写化学式)________。
(4)下列可作为比较D和Na金属性强弱的依据是________。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)Y的氢化物和Z的单质在一定条件下反应生成Z的氢化物(产物之一),该反应的方程式为___________。
(6)有人建议将氢元素排在元素周期表的ⅣA族,请你从化合价的角度给出一个理由__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贵州的矿产资源丰富,在全国占优势地位的有铝、磷、煤、锰、重晶石、黄金、铅锌、锑等众多品种。回答下列问题:
(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期,基态金原子的外围电子排布图为__________;Cu2+能与多种离子或分子形成稳定性不同的配合物。经X射线衍射测得配合物酞菁铜的晶体结构,其局部结构如图所示:
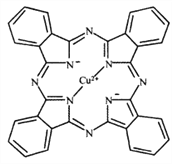
①酞菁铜结构中非金属元素电负性由大到小的顺序为__________;
②酞菁铜结构中N原子的轨道杂化类型为__________。酞菁铜结构中不存在的化学键类型为__________
A.配位键 B.金属键 C.σ键 D.π键
(2)煤通过干馏、气化、液化可获得清洁燃料和多种化工原料,氨是其中之一。NH3的 VSEPR模型为__________。
(3)锰、铁两元素中第三电离能较大的是__________(填元素符号),原因是___________。
(4)碲化锌(ZnTe)具有宽禁带的特性,常用于制作半导体材料,碲化锌晶体有立方和六方两种晶型,其立方晶胞结构如下图所示。
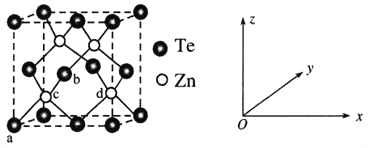
①原子坐标参数表示晶胞内部各原子的相对位置。已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() )。则d的原子坐标参数为__________。
)。则d的原子坐标参数为__________。
②若两个距离最近的Te原子间距离为apm,则晶体密度为__________g/cm3(列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com