
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ
��1��N2��g����H2��g����Ӧ����1mol NH3��g�����ų�46.1KJ������
��2��0.5mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�445kJ��������
��3����ͼ��ʾ��NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ�� 
��4���Ͻ�������Ͼ�����������������ܣ�����Ͻ�ɴ���CO��H2�ϳ�CH4�ķ�Ӧ���¶�ΪTʱ���÷�Ӧ���Ȼ�ѧ����ʽΪ
��֪�¶�ΪTʱ��
CH4��g��+2H2O�TCO2��g��+4H2��g����H=+165KJmol
CO��g��+H2O��g���TCO2��g��+H2��g����H=��41KJmol��
���𰸡�
��1���⣺��ΪN2��g����H2��g����Ӧ����1mol NH3��g�����ų�46.1KJ��������1molN2��g����3molH2��g����Ӧ����2mol NH3��g�����ų�46.1��2KJ���������Է�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��2NH3��g����H=��92.2kJmol��1���ʴ�Ϊ��N2��g��+3H2��g��2NH3��g����H=��92.2kJmol��1
��2���⣺��Ϊ0.5mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�445kJ����������1mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�890kJ�����������Է�Ӧ���Ȼ�ѧ����ʽΪ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����=��890kJmol��1���ʴ�Ϊ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����=��890kJmol��1
��3���⣺��ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����Ϊ��368��134=234kJ��
��Ӧ�Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1 ��
�ʴ�Ϊ��NO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1
��4��CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJ?mol��1
���������⣺��4����֪����CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJmol��1
��CO��g��+H2O��g���TCO2��g��+H2��g����H=��41kJmol��1 ��
���ݸ�˹���ɣ��ک��ٿɵã�CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJmol��1 ��
���Դ��ǣ�CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJmol��1 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��ҹ����¿Ƽ��ɹ���˵������ȷ���ǣ� ��
A.�������ǵ�̫���ܵ�ذ�ɽ�̫����ֱ��ת��Ϊ����
B.�����ɻ�C919ʹ�õ�ȼ�Ϳɴ�ʯ���з���õ�
C.���������˺���ʹ�õ�̼��ά�������ǽ�������
D.����̫��֮�ⳬ�����������ʹ�õĹ�����Ҫ�ɷ�Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һС������ƾ����ڿ����У����յõ��IJ�����
A. Na2OB. Na2O2C. NaOHD. Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ״�������ȼ�ϵ�أ����й����Ŀ�����Ӧ��ǰ�����ش���������
��1���״�ȼ�ϵ�أ����DMFC�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ1��ʾ��ͨ��a����ĵ缫��ԭ��ص����������������������缫��ӦʽΪ ��
��2��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ�飬��ͼ2��ʾU�ι����Ȼ�����Һ�����Ϊ800ml���պ�K����ÿ����ؼ���������Ϊ0.224L����������ҷ�Ӧ��ȫ����������ͨ�����صĵ���Ϊ�������ڳ���F=9.65��104C/mol����������������ȫ���ݳ���������Һ��Ͼ��ȣ�����U�ι�����Һ��pHΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������  ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£�
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£� 
![]()
�����õ����й��������£�
���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
�Ҷ��� | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ��1.44g��25��ʱ2.3g���������Ҵ��������ڱ� | 146 |
ʵ�鲽�����£�
I����������ƿ�м���16mL 50%�����ᣨ�ܶ�Ϊ1.31g/cm3�����ټ���1��2����ʯ����Һ©����ʢ����5.4mL��������
��ˮԡ����������ƿ��50�����ң���ȥˮԡ�������μ�5��6�λ�������ҡ��������ƿ���۲쵽�к���ɫ����ų�ʱ�������μ�ʣ�µĻ�������ά�ַ�Ӧ�¶���60�桫65��֮�䣮
��������ȫ��������������80�桫90��ˮԡ����Լ10min��ע������¶ȣ���ֱ������ɫ��������Ϊֹ��
IV�����Ƚ���ӦҺ�����ձ��У������ˮԡ����ȴ�������������ˡ�ϴ�ӵôֲ�Ʒ��V���ֲ�Ʒ���ᴿ�����Ϊ5.7g��
��ش��������⣺
��1������b������Ϊ ��
��2����������ƿ�еμӻ�����ʱ��Ҫ���ƺû������ĵ������ʣ���ֹ��Ӧ���ھ��ҵ����¶�Ѹ����������������ɽ����صĺ�������о�һ�����ܲ����ĺ���� ��
��3����֪��NaOH��Һ����β��ʱ��������ط�Ӧ����ʽΪ��2NO2+2NaOH�TNaNO2+NaNO3+H2O��NO+NO2+2NaOH�T2NaNO2+H2O��������ô�����Һ����β��ʱҲ�ܷ������Ʒ�Ӧ������ط�Ӧ����ʽΪ���� ��
��4��Ϊ�˳�ȥ���ܵ����ʺͼ��ٲ�Ʒ��ʧ���ɷֱ��ñ�ˮ��ϴ�Ӿ��壮
��5���ֲ�Ʒ�������ᴿ����ʵ��������ƣ�����ʵ�����õ��ļ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ� ��
A.Ũ��������м��Ӧ��2Fe+6H+�T2Fe3++3H2��
B.����CuSO4��Һ��Ӧ��2Na+Cu2+�TCu��+2Na+
C.NaHCO3��Һ��ϡH2SO4��Ӧ��CO ![]() +2H+�TH2O+CO2��
+2H+�TH2O+CO2��
D.��FeCl3��Һ�м���Mg��OH��2��3Mg��OH��2+2Fe3+�T2Fe��OH��3+3Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ��(�г���������ȥ)̽��ͭ˿�����Ũ���ᷴӦ�IJ�������й�˵������ȷ���� ��������
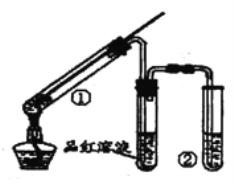
A. Ʒ����Һ����������֤SO2��Ư����
B. �Թܢ���ʢ�ŵ��Լ�������NaOH��Һ��Na2SO3��Һ
C. ֹͣ��Ӧ������������м�ˮ����Һ����ɫ
D. �÷�Ӧ��Ũ����ȱ�����ǿ�����ԣ��ֱ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com