
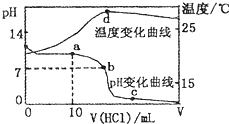
 �����£���1.00mol?L-1�������20.00 mL 1.00mol?L-1�İ�ˮ�У���ҺpH���¶��������������ı仯������ͼ��ʾ�������й�˵���в���ȷ���ǣ�������
�����£���1.00mol?L-1�������20.00 mL 1.00mol?L-1�İ�ˮ�У���ҺpH���¶��������������ı仯������ͼ��ʾ�������й�˵���в���ȷ���ǣ�������A��a����Һ������Ũ�ȴ�С�Ĺ�ϵ��c��NH
| ||
B��b����Һ������Ũ�ȴ�С�Ĺ�ϵ��c��NH
| ||
C��c����Һ������Ũ�ȴ�С�Ĺ�ϵ��c��NH
| ||
| D��d��ʱ��Һ�¶ȴﵽ��ߣ�֮���¶������½���ԭ����NH3?H2O�������� |
+ 4 |
+ 4 |


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���1.00mol?L-1�������20.00mL1.00mol?L-1��ˮ�У���ҺpH�������
�����£���1.00mol?L-1�������20.00mL1.00mol?L-1��ˮ�У���ҺpH��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?������һģ�������£���1.00mol?L��1�������20.00mL 1.00mol?L��1��ˮ�У���ҺpH�������������仯����������ͼ��ʾ������˵����ȷ���ǣ�������
��2012?������һģ�������£���1.00mol?L��1�������20.00mL 1.00mol?L��1��ˮ�У���ҺpH�������������仯����������ͼ��ʾ������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���1.00mol/L�������20.00mL 1.00mol/L��ˮ�У���ҺpH���¶ȣ��棩
�����£���1.00mol/L�������20.00mL 1.00mol/L��ˮ�У���ҺpH���¶ȣ��棩+ 4 |
| ����Ũ�ȵĹ�ϵ | ���� | ��Һ��pH | �����غ��ϵ | |
| �� | C��NH4+����C��Cl-����C��OH-����C��H+�� | NH4Cl��NH3?H2O NH4Cl��NH3?H2O |
pH��7 | / |
| �� | NH4Cl | / | c��NH4+��+c��NH3?H2O��=c��Cl-�� c��NH4+��+c��NH3?H2O��=c��Cl-�� | |
| �� | C��Cl-����C��H+����C��NH4+����C��OH-�� | NH4Cl��HCl NH4Cl��HCl |
pH��7 | / |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���1.00mol • L��1�������20. OO mL 1.OOmol • L��1�İ�ˮ�У���ҺpH���¶��������������ı仯��������ͼ��ʾ��
�����й�˵���в���ȷ����
A.a����Һ������Ũ�ȴ�С�Ĺ�ϵ��
B.b����Һ������Ũ�ȴ�С�Ĺ�ϵ��
C.c����Һ������Ũ�ȴ�С�Ĺ�ϵ��
D.d��ʱ��Һ�¶ȴﵽ��ߣ�֮���¶������½���ԭ����NH3 • H2O��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com