
����Ŀ��ijС��ͬѧ�о�SO2��KI��Һ�ķ�Ӧ���������ʵ�顣
ʵ�� | ���� | ���� |
I |
| ��ҺѸ�ٱ�Ϊdz��ɫ������Һ�������ķ������������ ���������Һ������ɫ |
II |
| ��Һ����������ɫ������Һ�������ķ�����dz��ɫ�����������Һ��ɫ��dz�����������Һ������ɫ |
��1�����������Һ��Ŀ����______��Ϊ�ﵽ��ͬ��Ŀ�ģ�����ѡ�õ��Լ���______��
��2�������飬II�е�dz��ɫ��������������ʾ�������������£�SO2��KI��Һ��Ӧ����S��I2��
�� �����������£�SO2��KI��Һ��Ӧ�����ӷ���ʽ��______��
�� ���II�м��������Һ����ɫ����ͬѧ������裺______��Ϊ֤ʵ�ü��裬��ͬѧȡII�����ķ�������Һ�����������ữ��BaCl2��Һ���а�ɫ�������ɡ�
�� ��ͬѧ��Ϊ��ͬѧ��ʵ�鷽����֧���������裬������______��
�� ��ͬѧ��1 mL 1 mol��L1 KCl��Һ�м���5��1 mol��L1���ᣬͨ��SO2��������ʵ�������ټ��������ữ��BaCl2��Һ������û�а�ɫ��������ͬѧ��ʵ�������______��
��3��ʵ�������I��SO2ת���Ĵ�������ȫ�������ӷ���ʽ��
SO2��H2O ===_____ �� ��
��4���Ա�ʵ��I��II���Ʋ�����H+��Ũ�ȿɼӿ�SO2��ת�����ʡ�Ϊ֤ʵ���Ʋ⣬�����һ������ʵ��֤����ʵ�鷽����______��
���𰸡������Ƿ���I2���� CCl4������ú�ͣ� SO2 +4I +4H+ == 2I2 +S+2H2O SO2��I2��ԭΪI �����е�O2��SO2����ΪSO42 O2����SO2����ΪSO42����Ҫԭ�� 3SO2+2H2O === 4H++ 2SO42 +S ��1 mL 1 mol��L1 KI��Һ�м��� 5��1 mol��L1 KCl��Һ����ͨ�� SO2���壬�۲�����
��������
��1������������Һ��ɫ�����������л��ܼ����ҵ�����Ȼ�̼��Һ���Ϻ�ɫ��
��2�������飬II�е�dz��ɫ��������������ʾ�������������£�SO2��KI��Һ��Ӧ����
�������������£�SO2��KI��Һ��ӦS��I2������غ㷨д��������Ӧ�����ӷ���ʽ��
�����ķ�������Һ�����������ữ��BaCl2��Һ���а�ɫ�������ɣ�˵����Һ����SO42-��˵��I2������SO2����SO42-��
�ۿ�������������Ҳ������SO2��
�ܼ��������ữ��BaCl2��Һ������û�а�ɫ������˵����Һ����SO42-��
��3��I��SO2ת���Ĵ�������֪SO2�ڷ�Ӧ�мȱ���������SO42-���ֱ���ԭ����S������غ㷨��ƽ���ӷ�Ӧ����ʽ��
��4��ͨ���ı�H+��Ũ�����ж�SO2��ת�������Ƿ����ı䣻
��1�����õ���������Һ��ɫ�����������Һ�ɼ��鷴Ӧ���е����ɣ����������л��ܼ���Ҳ���Լ���CCl4�����ã����л����Ƿ����Ϻ�ɫ�����жϷ�Ӧ���е����ɣ�
��2���������������£�SO2��KI��Һ��ӦS��I2��������Ӧ�����ӷ���ʽΪSO2 +4I +4H+ == 2I2 +S+2H2O��
��II�м��������Һ����ɫ��˵��I2����ԭ�����SO2���л�ԭ�ԣ��ɼ���SO2��I2��ԭΪI��
����ͬѧ��Ϊ��������������Ҳ�ܽ�SO2����ΪSO42���ʲ�֧�ּ�ͬѧ���������裻
�ܼ��������ữ��BaCl2��Һ������û�а�ɫ������˵����Һ����SO42-���ɴ˿ɵó�O2����SO2����ΪSO42����Ҫԭ��
��3��I��SO2ת���Ĵ�������֪SO2�ڷ�Ӧ�мȱ���������SO42-���ֱ���ԭ����S��������Ӧ�����ӷ�Ӧ����ʽΪ3SO2+2H2O === 4H++ 2SO42 +S��
��4����1 mL 1 mol��L1 KI��Һ�м��� 5��1 mol��L1 KCl��Һ����ͨ�� SO2���壬�۲��������ж�����H+��Ũ���Ƿ�ɼӿ�SO2��ת�����ʡ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ԫ�����ڱ�,����������⡣

��1����Ԫ�����ڱ���ȫ���ǽ���Ԫ�ص�����Ϊ_____________��
a.A b.B c.C d.D
��2��I��IIԪ���γɵĻ�����Ļ�ѧʽΪ_____��һ������____����
��3�����мס������ֶ�����Ԫ��,������,��Ԫ�صĵ��������Ũ���������б��涼���������ܵ�����Ĥ,��Ԫ��ԭ�Ӻ�����������һ���ϵĵ�������ȡ�
�ٽ��ס�����Ԫ�ص�Ԫ�ط�����д������Ԫ�����ڱ��ж�Ӧ��λ��__��д��������NaOH��Һ��Ӧ�����ӷ���ʽ____��
�ڼס�����Ԫ����,�����Խ�ǿ����_____(��Ԫ������),������֤�ý��۵�ʵ����____(�����)��
a.���ڿ����з����Ѿõ�������Ԫ�صĵ��ʷֱ������ˮ��
b.��������Ԫ�صĵ��ʷ�ĩ�ֱ����ͬŨ�ȵ����ᷴӦ
c.��������Ԫ�صĵ��ʷ�ĩ�քe����ˮ����,�������̪��Һ
d.�Ƚ�������Ԫ�ص���̬�⻯����ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һԪ����HA�ĵ���ƽ�ⳣ��K ��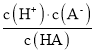 ��25��ʱ��CH3COOH��HCN��H2CO3�ĵ���ƽ�ⳣ�����£�
��25��ʱ��CH3COOH��HCN��H2CO3�ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | HCN | H2CO3 |
K | 1.75��10�C5 | 4.9��10�C10 | K1 = 4.4��10�C7 K2 = 5.6��10�C11 |
����˵����ȷ����
A. ϡ��CH3COOH��Һ�Ĺ����У�n(CH3COO�C)��С
B. NaHCO3��Һ�У�c(H2CO3) �� c(![]() ) �� c(HCO3)
) �� c(HCO3)
C. 25��ʱ����ͬ���ʵ���Ũ�ȵ�NaCN��Һ�ļ���ǿ��CH3COONa��Һ
D. ��CH3COOH��Һ��HCN��Һ�м���Na2CO3��Һ��������CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��صķ����ǻ�ѧ�������һ���ش��ס�
��1��һ������ȼ�ϵ�أ����Զ�ײ���Ϊ�����缫����ϡ�����У�Ȼ��ֱ�������ͨ����������������õ��ܡ�ͨ�������ĵ缫��ӦʽΪ_________________��
��2�����ӹ�ҵ�ϳ�����FeCl3��Һ��ʴͭ������ӡˢ��·�������÷�Ӧԭ����Ƴ�ԭ��أ���д��ԭ��ص�������Ӧ______________________________��
��3�������£�����ȥ��������Ĥ����Ƭ��ͭƬ����ŨHNO3�����ԭ���װ����ͼ����ʾ�����ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ����ʾ����Ӧ�������к���ɫ���������

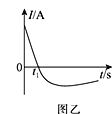
t1sǰ��ԭ��صĸ�������Ƭ�������ĵ缫��ӦʽΪ________����Һ�е�H����______����������������ƶ���t1s�����·�е��������������ı䣬��ԭ����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦX(g)��2Y(g)![]() Z(g) ��H ��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����( )
Z(g) ��H ��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����( )

A. ����������м���1molX��2molY����ƽ��ʱ��X��ƽ��Ũ��С��0.125mol/L
B. a������Ӧ���ʴ����淴Ӧ����
C. ��Ӧ��ƽ��ʱ�������¶ȿ���ʵ��c��d��ת��
D. �������£���Ӧ��ƽ��ʱ��ƽ�ⳣ��K=3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ��������ʵ�飬�������ǣ� ����

A. ͼ�٣���֤H2CO3����ǿ��H2SiO3 B. ͼ�ڣ��ռ�CO2��NH3
C. ͼ�ۣ�����Na2CO3��Һ��CH3COOC2H5 D. ͼ�ܣ�����C2H5OH��CH3COOC2H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʥ·��˹��ѧ���Ƶ������Ҵ�ȼ�ϵ��, ���ܴ���������H+���Ľ������ܼ�, ��ӦΪC2H5OH��3O2��2CO2��3H2O����ͼ�Ǹõ�ص�ʾ��ͼ������˵����ȷ������ ��

A��a��Ϊ��ص�����
B����������ĵ缫��ӦΪ��4H+ �� O2 �� 4e��=== 2H2O
C����ع���ʱ������a���ص��߾������ٵ�b��
D����ع���ʱ��1mol�Ҵ�������ʱ����6 mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˵������֤����ӦN2��3H2![]() 2NH3�ﵽƽ��״̬
2NH3�ﵽƽ��״̬
A.1��N��N���γɵ�ͬʱ����3��H��H���γ�
B.1��N��N�����ѵ�ͬʱ����3��H��H������
C.1��N��N�����ѵ�ͬʱ����6��N��H������
D.1��N��N�����ѵ�ͬʱ����6��N��H���γ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com