
【题目】已知可逆反应X(g)+2Y(g)![]() Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
【答案】B
【解析】
试题A.根据图像可知,在反应开始时加入2molX 、4molY,二者的物质的量的比是1:2,若向该容器中加入1molX、2molY,二者的物质的量的比也是1:2,该反应是反应前后气体体积相等的反应,所以改变压强,化学平衡不发生移动,则当达到平衡时X的浓度是原来的1/2,c(X)=0.125mol/L,错误;B.根据题意可知反应从正反应方向开始,到c点时达到化学化学平衡,此时正反应速率与逆反应速率相等,所以在达到平衡前的a点,正反应速率大于逆反应速率,正确;C.反应达平衡时,降低温度化学平衡向放热的正反应方向移动,反应物的浓度会降低,所以不可能实现c到d的转化,错误;D.该条件下,反应达平衡时,平衡常数,各种物质的浓度分别是c(X)=0.25mol/L,c(Y)=0.5mol/L,c(Z)=0.75mol/L,所以该反应的化学平衡常数K= c(Z)÷[c(X)×c2(Y)]= 0.75÷[0.25×0.52]=12,错误。


科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
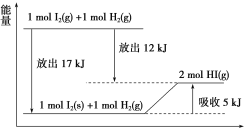
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
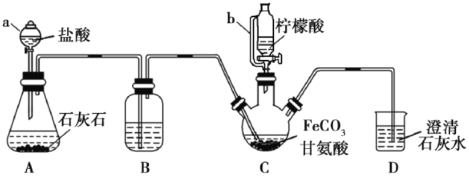
查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是_______________。
(2)装置B中盛有的试剂是:____________;装置D的作用是________________。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为____________________________。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
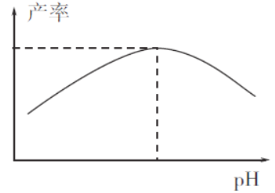
①pH过低或过高均导致产率下降,其原因是_____________________;
②柠檬酸的作用还有________________________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法正确的是:

A.过程Ⅰ的反应为6FeO+O2![]() 2Fe3O4
2Fe3O4 ![]()
B.过程Ⅱ中H2为还原剂
C.整个过程的总反应为:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.FeO是过程Ⅰ的氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学研究SO2和KI溶液的反应,设计如下实验。
实验 | 操作 | 现象 |
I |
| 溶液迅速变为浅黄色,将溶液进行离心分离无固体沉积, 加入淀粉溶液,不变色 |
II |
| 溶液立即变成深黄色,将溶液进行离心分离有浅黄色固体沉积,溶液黄色变浅,加入淀粉溶液,不变色 |
(1)加入淀粉溶液的目的是______,为达到相同的目的,还可选用的试剂是______。
(2)经检验,II中的浅黄色固体是硫。资料显示,在酸性条件下,SO2和KI溶液反应生成S和I2。
① 在酸性条件下,SO2和KI溶液反应的离子方程式是______。
② 针对II中加入淀粉溶液不变色,甲同学提出假设:______。为证实该假设,甲同学取II中离心分离后的溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀生成。
③ 乙同学认为甲同学的实验方案不支持上述假设,理由是______。
④ 丙同学向1 mL 1 mol·L1 KCl溶液中加入5滴1 mol·L1盐酸,通入SO2,无明显实验现象,再加入盐酸酸化的BaCl2溶液,几乎没有白色沉淀。丙同学的实验结论是______。
(3)实验表明,I是SO2转化的催化剂。补全下列离子方程式。
SO2+H2O ===_____ + +
(4)对比实验I和II,推测增大H+的浓度可加快SO2的转化速率。为证实该推测,还需进一步进行实验证明,实验方案是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的分子结构也可用键线式表示为:![]() ,有机物A的键线式为
,有机物A的键线式为![]() ,A可由有机物B与等物质的量氢气通过加成反应得到。
,A可由有机物B与等物质的量氢气通过加成反应得到。
(1)有机物A的分子式为___________。
(2)有机物A的名称是_______________。
(3)在A 的主链为5个C原子的所有同分异构体中,其分子结构中含有3个甲基的有机物的名称是_______________。
(4)有机物B可能的结构简式有![]() 、_______________、_______________、_______________、_______________。
、_______________、_______________、_______________、_______________。
(5)请写出![]() 在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com