
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
【答案】增大 a>b>d>c cd b > > > 9.9×10-7 moL·L-1
【解析】
(1)升高温度促进弱电解质的电离;
(2)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(3)酸性强弱为CH3COOH > H2CO3> HClO > HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(4)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以n(CH3COO-)、n(H+)、n(CH3COOH)都减小,据此分析解答;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;酸性不同的两种一元弱酸,体积相同,pH相同,酸越弱,浓度越大,中和时消耗的氢氧化钠越多;
(6)根据混合液中的电荷守恒计算。
(1)升高温度促进弱电解质的电离,所以当温度升高时,Ka增大;
因此,本题正确答案是:增大;
(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH > H2CO3> HClO > HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO- >HCO3- >CH3COO- ,即a>b>d>c,
因此,本题正确答案是:a>b>d>c;
(3) a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b. ClO-+CH3COOH=CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c. CO32-+2HClO=CO2↑+H2O+2ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d. 2ClO-+CO2+H2O=CO32-+2HClO:因为酸性H2CO3> HClO > HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
因此,本题正确答案是:cd;
(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以![]() 的比值减小,故a错误;
的比值减小,故a错误;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则![]() 的比值增大,故b正确;
的比值增大,故b正确;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以![]() 的比值减小,故c错误;
的比值减小,故c错误;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,![]() 的比值减小,故d错误;
的比值减小,故d错误;
因此,本题正确答案是:b;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,
因此,本题正确答案是:>;>;>;
(6)pH=6,则c(H+)=10-6mol/L、c(OH-)=10-8mol/L,
溶液呈存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
则:c(CH3COO-)- c(Na+)=c(H+)-c(OH-) =10-6mol/L-10-8mol/L=9.9×10-7mol/L,
因此,本题正确答案是:9.9×10-7mol/L。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(Ls),则正确的关系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
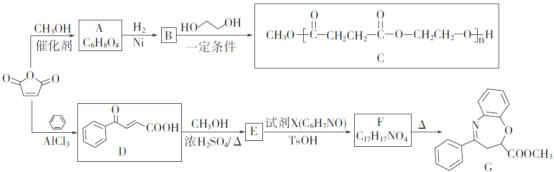
已知: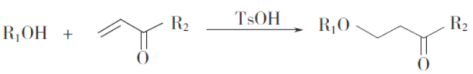
(1)A含有的官能团名称是______________。
(2)D→E的反应类型是_____________________。
(3)E的分子式是____________;F的结构简式是_________________。
(4)B→C的化学方程式为________________________________________。
(5)W是B的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为___________。
(6)设计由甲苯和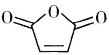 为原料制备化合物
为原料制备化合物![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠病毒爆发期间,各类消毒剂大显身手,ClO2泡腾片就是一种,使用时将其投入水中即可产生ClO2对水体、环境消毒。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。


(1)仪器P的名称是__。
(2)写出装置A中烧瓶内发生反应的离子方程式__。
(3)B装置中所盛试剂是__。
(4)F为ClO2收集装置,应选用的装置是__(从①②③中选择),其中与E装置导管相连的导管口是__(填导管口的字母)
(5)相同条件下,ClO2的消毒能力是Cl2的__倍(以等物质的量的消毒剂得电子的数目计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
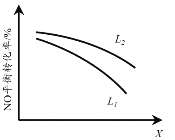
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
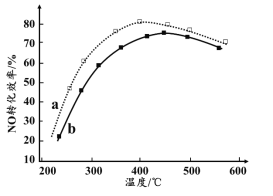
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。以铅泥(PbSO4、PbO、Pb及其他杂质等)为原料制备三盐的工艺流程如下图所示
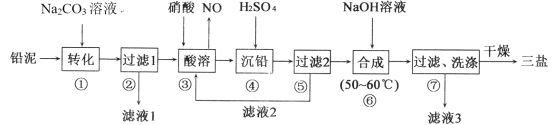
已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的主要离子方程式_______。
(2)根据图溶解度曲线,由滤液I得到Na2SO4固体的操作为:将“滤液1”________、______、用乙醇洗涤后干燥。
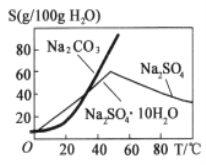
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是____________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为___(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=____mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为___________。
(6)若消耗100 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75.0%转化为三盐,则铅泥中铅元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;B溶于A后所得的物质与E微粒反应后可得C和一种白色沉淀。请回答:
(1)A的结构式为______________。
(2)B的电子式为______________。
(3)D的电子式为______________。
(4)B溶于A后所得的物质与E微粒反应后可得C和一种白色沉淀,写出该反应的离子方程式____________________________(写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与水反应剧烈;钠与乙醇反应平缓 | 羟基中氢的活泼性:H2O> C2H5OH |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com