
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
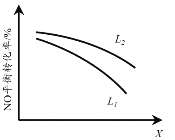
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
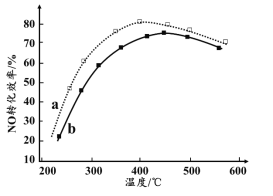
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
【答案】2NO(g)+2CO(g) == N2(g)+2CO2(g) △H == 746.5 kJ·mol1 2.25 ×104 温度 L2>L1,该反应为气体体积减小的反应,压强增大,NO转化率增大 CO(NH2)2+H2O![]() 2NH3+CO2 > 随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大;温度升高,催化剂活性增加,都导致化学反应速率加快 当温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO等
2NH3+CO2 > 随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大;温度升高,催化剂活性增加,都导致化学反应速率加快 当温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO等
【解析】
I.(1)已知:①C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1,②2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1 ,③N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1,由盖斯定律可知①×2-②-③得2NO(g)+2CO(g) == N2(g)+2CO2(g),由此计算此反应的△H;
(2)①根据υ(CO)=![]() 计算前4 s内的平均反应速率υ(CO);
计算前4 s内的平均反应速率υ(CO);
②图中L一定时,NO(g)的平衡转化率随X的增大,转化率降低,说明逆向进行,结合反应2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1升高温度时平衡逆向进行,增大压强时平衡正向进行分析;
II.(3)尿素[CO(NH2)2]水溶液温度高于160℃时尿素水解,产生 NH3,根据质量守恒可知,同时有CO2气体生成,结合守恒法写出尿素水解的化学方程式;
(4)①反应中,增大一种反应物的量可提高另一种反应物的转化率;
②温度升高有利于尿素水解生成NH3,且提高催化剂的活性,催化效果好;NH3在加热条件下催化氧化能生成NO。
I.(1)已知:①C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1,②2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1 ,③N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1,由盖斯定律可知①×2-②-③得2NO(g)+2CO(g) == N2(g)+2CO2(g),则△H=2(△H1)-(△H2)-(△H3)=2( 393.5kJ·mol1)-( 221.0 kJ·mol1)-(+180.5 kJ·mol1),故CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1;
(2)①前4 s内的平均反应速率υ(CO)=![]() =
=![]() mol·L1·s1=2.25×104mol·L1·s1;
mol·L1·s1=2.25×104mol·L1·s1;
②图中L一定时,NO(g)的平衡转化率随X的增大,转化率降低,说明逆向进行,结合反应2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1升高温度时平衡逆向进行,增大压强时平衡正向进行,可知X代表的物理量是温度;当温度一定时,增大压强,平衡正向移动,NO的转化率增大,故L2>L1;
II.(3)尿素[CO(NH2)2]水溶液温度高于160℃时尿素水解,产生 NH3,根据质量守恒可知,同时有CO2气体生成,则尿素水解的化学方程式为CO(NH2)2+H2O![]() 2NH3+CO2;
2NH3+CO2;
(4)①增大尿素的量可提高NO的转化率,即尿素与NO物质的量比值越大,NO的转化率越大,则图象中a>b;
②由图可知,随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大,且温度升高,催化剂活性增加,导致化学反应速率加快,故温度升高,NO转化效率升高;但温度过高,
,原因是______。温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO,导致NO浓度升高,NO转化效率下降。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
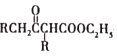 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
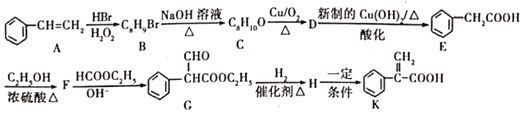
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(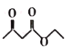 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
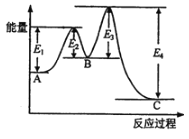
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是__,还原性I-__NO(填“>”或“<”)。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有__(填序号)。
(3)请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+_H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、Cr3+对环境具有极强的污染性,含有
、Cr3+对环境具有极强的污染性,含有![]() 、Cr3+的工业废水常采用NaOH沉淀方法除去。
、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成![]() :Cr3++3OH
:Cr3++3OH![]() Cr(OH)3
Cr(OH)3![]()
![]() +H++H2O。②
+H++H2O。②![]() 还原产物为Cr3+。③lg3.3=0.50。
还原产物为Cr3+。③lg3.3=0.50。
请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)根据2![]() +2H+
+2H+![]()
![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
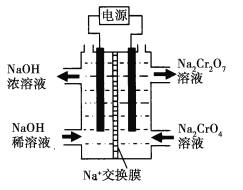
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为______________________________。
(2)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(3)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_________________________________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com