
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
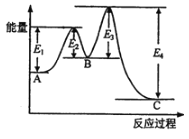
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__、其中6Li、7Li互为__,用电子式表示Li2O的形成过程___。
(2)金属钾19K位于元素周期表中的第__周期、第__族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___;超氧化钾与水反应如下,请配平该反应的化学方程式:
_KO2+_H2O=_KOH+_O2↑+_H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__、可作半导体材料的元素是__(填名称),当反应H2+Cl2![]() 2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.①③④B.②③C.①④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+第M层的电子排布式为_______________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
(3)FeSO4常作补铁剂,SO42-的立体构型是_______________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______molσ键,与CO互为等电子体的离子是________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
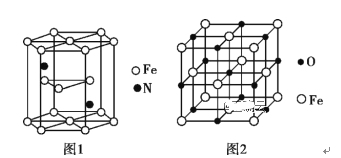
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉酸甲酯的一种合成路线如下:
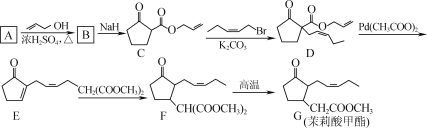
(1) C中含氧官能团名称为________。
(2) D→E的反应类型为________。
(3) 已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(5) 写出以 和CH2(COOCH3)2为原料制备
和CH2(COOCH3)2为原料制备 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
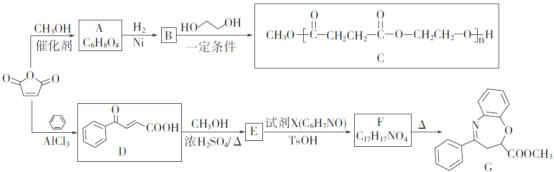
已知: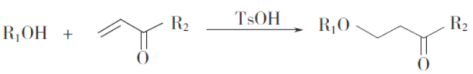
(1)A含有的官能团名称是______________。
(2)D→E的反应类型是_____________________。
(3)E的分子式是____________;F的结构简式是_________________。
(4)B→C的化学方程式为________________________________________。
(5)W是B的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为___________。
(6)设计由甲苯和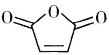 为原料制备化合物
为原料制备化合物![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e-2H2O
②负极反应为:2H2-4e-4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④氢离子通过电解质向负极移动
A. ①② B. ②③④ C. ①② ③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
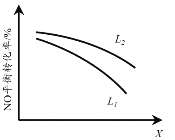
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
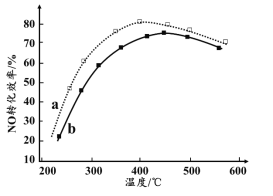
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z在周期表中的位置如图所示,下列说法错误的是( )
![]()
A. 简单氢化物沸点:X>Z
B. 用pH试纸可测得YZX和YZX4溶液分别显碱性和中性
C. W的单质可用于工业冶炼铁、硅
D. 原子半径:Y>W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com