
【题目】关于下图的说法不正确的是( )
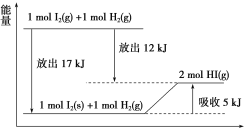
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
【答案】D
【解析】
A.由图可知,1 mol I2(s)和1 mol H2(g)吸收5 kJ热量生成2 mol HI(g),A正确;
B.由图可知,1 mol I2(g)和1 mol H2(g)生成2 mol HI(g)放出12 kJ热量,则2 mol HI(g)分解生成1 mol I(g)与1 mol H2(g)时需要吸收12 kJ的能量,B正确;
C.由图可知,1 mol I2(g)变为1 mol I2(s)放出17 kJ的热量,则1 mol固态碘变为1 mol碘蒸气时需要吸收17 kJ的能量,C正确;
D.由图可知,1 mol I2(g)+1 mol H2(g)生成2 mol HI(g)放出12 kJ热量,应为放热反应,D错误。
答案为D。


科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,某学习小组在实验室模拟从海水提取氯化钠晶体,其实验流程如下:

通过查阅资料可知:粗盐中含有CaCl2、MgCl2、Na2SO4等杂质。该学习小组通过讨论,设计实验在从粗盐精制得到食盐水的过程为:
①取一定量的粗盐溶解;
②向粗盐水中依次加入过量的Na2CO3溶液、加入过量的NaOH、加入过量的BaCl2溶液;
③过滤;
④向滤液中加入适量盐酸。
回答:
(1)溶解时需要的仪器有________。
(2)加入过量的Na2CO3溶液时观察到的现象是________;反应的化学方程式为_______________________________。
(3)实验后,通过进一步反复论证,向老师求证,发现在粗盐精制得到食盐水的设计方案中________(“有”或“没有”)不妥之处,理由是______________________。
(4)该学习小组同学要从食盐水得到氯化钠晶体时,还要进行________、______、过滤。
(5)该学习小组同学用实验得到的晶体配制1mol·L-1的NaCl溶液500mL,在配制过程中,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③定容时仰视刻度线
④定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是__,画出配合物离子[Cu(NH3)4]2+中的配位键__.
(2)根据VSEPR模型,H3O+的分子立体结构为__,BCl3的立体结构为__.
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)
正四面体分子__,三角锥形分子__,V形分子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(Ls),则正确的关系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为_____________。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化学式为_____,一定含有____键。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__并写出甲单质与NaOH溶液反应的离子方程式____。
②甲、乙两元素中,金属性较强的是_____(填元素名称),可以验证该结论的实验是____(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分別和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
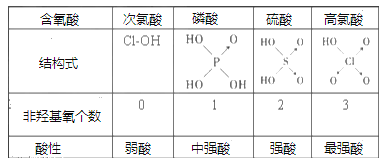
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
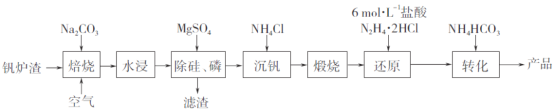
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com