
【题目】海水中蕴藏着丰富的资源,某学习小组在实验室模拟从海水提取氯化钠晶体,其实验流程如下:

通过查阅资料可知:粗盐中含有CaCl2、MgCl2、Na2SO4等杂质。该学习小组通过讨论,设计实验在从粗盐精制得到食盐水的过程为:
①取一定量的粗盐溶解;
②向粗盐水中依次加入过量的Na2CO3溶液、加入过量的NaOH、加入过量的BaCl2溶液;
③过滤;
④向滤液中加入适量盐酸。
回答:
(1)溶解时需要的仪器有________。
(2)加入过量的Na2CO3溶液时观察到的现象是________;反应的化学方程式为_______________________________。
(3)实验后,通过进一步反复论证,向老师求证,发现在粗盐精制得到食盐水的设计方案中________(“有”或“没有”)不妥之处,理由是______________________。
(4)该学习小组同学要从食盐水得到氯化钠晶体时,还要进行________、______、过滤。
(5)该学习小组同学用实验得到的晶体配制1mol·L-1的NaCl溶液500mL,在配制过程中,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③定容时仰视刻度线
④定容时俯视刻度线
【答案】烧杯、玻璃棒 溶液变浑浊,产生白色沉淀 Na2CO3+CaCl2=CaCO3↓+2NaCl 有 加入过量的BaCl2溶液时向盐水中引入杂质离子Ba2+,未进行去除 加热蒸发 冷却结晶 ④
【解析】
粗盐提纯,目的是要去除Ca2+,Mg2+和![]() 杂质离子,利用离子反应和物质的溶解性进行除杂,除杂顺序也要合理安排。第一步应该先加氯化钡溶液除去
杂质离子,利用离子反应和物质的溶解性进行除杂,除杂顺序也要合理安排。第一步应该先加氯化钡溶液除去![]() ,紧接着再加入碳酸钠溶液除去Ca2+的同时,也可以把第一步中的重金属离子Ba2+除去,随后加氢氧化钠溶液,除去Mg2+,最后加入适量盐酸,把第二步中过量的碳酸钠,和第三步中过量的NaOH反应消耗掉。如果不先脱除
,紧接着再加入碳酸钠溶液除去Ca2+的同时,也可以把第一步中的重金属离子Ba2+除去,随后加氢氧化钠溶液,除去Mg2+,最后加入适量盐酸,把第二步中过量的碳酸钠,和第三步中过量的NaOH反应消耗掉。如果不先脱除![]() ,那么后续步骤中无法将脱除
,那么后续步骤中无法将脱除![]() 过程中加入的Ba2+除去,产物不仅不纯,还会有毒。
过程中加入的Ba2+除去,产物不仅不纯,还会有毒。
(1)溶解需要将固体置于烧杯中加水,并用玻璃棒搅拌溶解;
(2)加入过量碳酸钠溶液的目的主要是去除杂质Ca2+,所以现象是溶液变浑浊,生成白色沉淀即CaCO3;
(3)题干中提供的方案非常不妥,因为脱除![]() 时加入溶液中的Ba2+无法去除;
时加入溶液中的Ba2+无法去除;
(4)由溶液获得结晶的操作是:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(5)①由于未进行洗涤操作,会使溶质损耗,根据公式![]() 分析,浓度偏低,不符合;
分析,浓度偏低,不符合;
②容量瓶不干燥,对于结果无影响,不符合;
③定容时仰视刻度线会使![]() 偏大,根据公式
偏大,根据公式![]() 分析,浓度偏低,不符合;
分析,浓度偏低,不符合;
④定容时俯视刻度线会使![]() 偏小,根据公式
偏小,根据公式![]() 分析,浓度偏大,符合;
分析,浓度偏大,符合;
答案选④。


科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为_____________。
(3)电极表面镀铂粉的原因为______________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LIH
2LIH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_________。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:
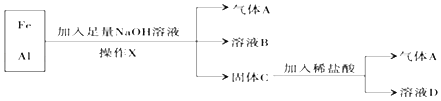
(1)操作X的名称是_____;
(2)气体A是_____ (填化学式 );
(3)加入足量NaOH溶液时发生反应的离子方程式为:_____;加入稀盐酸发生反应的离子方程式为:_____;
(4)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标况下,16gCH4含有分子数目为NA个
B.0.1 mol·L1氯化钠溶液含有的Na+数目为0.1NA
C.1 molH2O中含有质子数为10NA个
D.标况下,22.4L空气中含有分子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据如图所示的电解水原理进行实验,观察不同时间试管内的气体体积变化,则甲试管生成的气体是_______。

(2)假设电解了36g水,根据电解水的化学反应式计算生成氢气、氧气质量各为__________g;若在标况下,生成氢气、氧气体积各为_______________?
(3)根据实验观察和推算_______(“能”或“否”)得出初步结论:在相同温度和压强下,不同体积的O2和H2的其体积比等于其物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________。
②MgCO3分解温度比CaCO3低的原因是___________。
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有![]() 键的数目为________。
键的数目为________。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ),C为(
),C为(![]() );则D原子的坐标参数为________。
);则D原子的坐标参数为________。
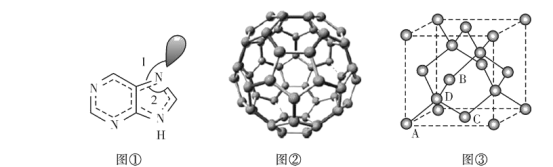
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图①所示,其中(〇为Se,●为Mn),则Se的配位数为____,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为![]() g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
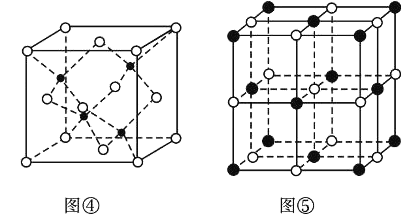
(7)KI的晶胞结构如图⑤所示,已知其晶体的密度为![]() g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
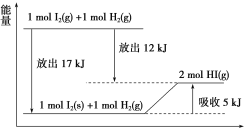
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com