
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
【答案】C
【解析】
A.实验中需2.00mol·L-1的NaCl溶液950mL,需要1000mL容量瓶,则配制时应称取的质量=2.00mol·L-1×1L×58.5g/mol=117.0g,故A正确;
B.标准状况下,11.2LHCl气体物质的量为![]() =0.5mol,溶于水配成1L溶液,其浓度=
=0.5mol,溶于水配成1L溶液,其浓度=![]() =0.5mol/L,故B正确;
=0.5mol/L,故B正确;
C.4g氢氧化钠的物质的量为0.1mol,溶于1L水中,溶剂的体积不能代表溶液的体积,所形成溶液浓度不为0.1mol·L-1,故C错误;
D.200mLFe2(SO4)3溶液中含Fe3+56g,即Fe3+的物质的量为![]() =1mol,则SO42-的物质的量=
=1mol,则SO42-的物质的量=![]() ×1mol=1.5mol,则溶液中SO42-的物质的量浓度=
×1mol=1.5mol,则溶液中SO42-的物质的量浓度=![]() =7.5mol/L,故D正确;
=7.5mol/L,故D正确;
答案选C。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图所示:
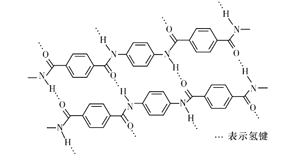
下列关于该高分子的说法不正确的是
A. 芳纶纤维可用作航天、航空、国防等高科技领域的重要基础材料
B. 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C. 氢键对该高分子的性能有影响
D. 结构简式为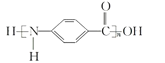
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,某学习小组在实验室模拟从海水提取氯化钠晶体,其实验流程如下:

通过查阅资料可知:粗盐中含有CaCl2、MgCl2、Na2SO4等杂质。该学习小组通过讨论,设计实验在从粗盐精制得到食盐水的过程为:
①取一定量的粗盐溶解;
②向粗盐水中依次加入过量的Na2CO3溶液、加入过量的NaOH、加入过量的BaCl2溶液;
③过滤;
④向滤液中加入适量盐酸。
回答:
(1)溶解时需要的仪器有________。
(2)加入过量的Na2CO3溶液时观察到的现象是________;反应的化学方程式为_______________________________。
(3)实验后,通过进一步反复论证,向老师求证,发现在粗盐精制得到食盐水的设计方案中________(“有”或“没有”)不妥之处,理由是______________________。
(4)该学习小组同学要从食盐水得到氯化钠晶体时,还要进行________、______、过滤。
(5)该学习小组同学用实验得到的晶体配制1mol·L-1的NaCl溶液500mL,在配制过程中,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③定容时仰视刻度线
④定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关计算正确的是
A.现有CO、CO2、O3三种气体,分别都含有1molO,则三种气体的物质的量之比为3∶2∶1
B.ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为![]()
C.标准状况下,11.2LX气体分子的质量为16g,则X气体的摩尔质量是32
D.4℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)1.7gNH3与标况下_________LH2S中的氢原子数相同
(2)在标准状况((___________)℃ 、_____________KPa)下,CO和CO2的混合气体共4.48L,质量为7.2g。则两种气体的物质的量之和为____________mol,该混合气体的平均相对分子质量为___________,其中CO2为___________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X和Y。
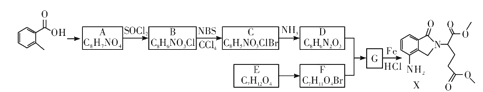
已知:①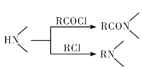 ;
;
②![]() ;
;
③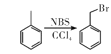 。
。
(1)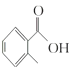 的名称是__________
的名称是__________
(2)G→X的反应类型是_____________。
(3)化合物B的结构简式为_____________。
(4)下列说法不正确的是__________(填字母代号)
A. 化合物A能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸反应
D.X的分子式是C15H16N2O5
(5)写出D+F→G的化学方程式:____________________
(6)写出化合物A(C8H7NO4)同时符合下列条件的两种同分异构体的结构简式_______。
①分子是苯的二取代物,1H—NMR谱表明分子中有4种化学环境不同的氧原子;
②分子中存在硝基和![]() 结构。
结构。
(7)参照以上合成路线设计E→![]() 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
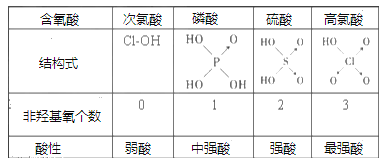
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com