
【题目】某研究小组拟合成医药中间体X和Y。
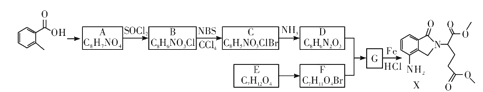
已知:①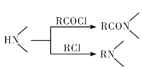 ;
;
②![]() ;
;
③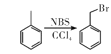 。
。
(1)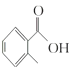 的名称是__________
的名称是__________
(2)G→X的反应类型是_____________。
(3)化合物B的结构简式为_____________。
(4)下列说法不正确的是__________(填字母代号)
A. 化合物A能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸反应
D.X的分子式是C15H16N2O5
(5)写出D+F→G的化学方程式:____________________
(6)写出化合物A(C8H7NO4)同时符合下列条件的两种同分异构体的结构简式_______。
①分子是苯的二取代物,1H—NMR谱表明分子中有4种化学环境不同的氧原子;
②分子中存在硝基和![]() 结构。
结构。
(7)参照以上合成路线设计E→![]() 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。
____________________________________________。
【答案】邻甲基苯甲酸 还原反应 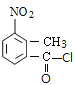 BD
BD 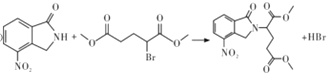
![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
由![]() 、A的分子式,纵观整个过程,结合X的结构,可知
、A的分子式,纵观整个过程,结合X的结构,可知![]() 发生甲基邻位硝化反应生成A为
发生甲基邻位硝化反应生成A为 ,对比各物质的分子,结合反应条件与给予的反应信息,可知A中羧基上羟基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B为
,对比各物质的分子,结合反应条件与给予的反应信息,可知A中羧基上羟基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B为 、C为
、C为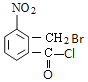 、D为
、D为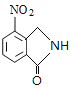 。由X的结构,逆推可知G为
。由X的结构,逆推可知G为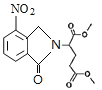 ,结合F、E的分子式,可推知F为CH3OOCCHBrCH2CH2COOCH3、E为CH3OOCCH2CH2CH2COOCH3。
,结合F、E的分子式,可推知F为CH3OOCCHBrCH2CH2COOCH3、E为CH3OOCCH2CH2CH2COOCH3。
根据上述分析可知:A为 ;B为
;B为 ;C为
;C为 ;D为
;D为 ;E为CH3OOCCH2CH2CH2COOCH3;F为CH3OOCCHBrCH2CH2COOCH3;G为
;E为CH3OOCCH2CH2CH2COOCH3;F为CH3OOCCHBrCH2CH2COOCH3;G为 。
。
(1)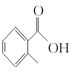 的甲基在苯环羧基的邻位C原子上,因此其名称是邻甲基苯甲酸;
的甲基在苯环羧基的邻位C原子上,因此其名称是邻甲基苯甲酸;
(2)G变X是-NO2变为-NH2,发生的是还原反应;
(3)化合物B的结构简式为 ;
;
(4)A.化合物A的苯环上有甲基,能酸性KMnO4溶液氧化,因而可以使酸性KMnO4溶液褪色,A正确;
B.化合物C结构简式是 ,含苯环与羰基能发生加成反应,有Br原子可以发生取代反应;由于Br原子连接的C原子直接连接在苯环上,因此不能发生消去反应,B错误;
,含苯环与羰基能发生加成反应,有Br原子可以发生取代反应;由于Br原子连接的C原子直接连接在苯环上,因此不能发生消去反应,B错误;
C.化合物D 含有亚氨基,能与稀盐酸反应,C正确;
含有亚氨基,能与稀盐酸反应,C正确;
D.根据物质的结构简式可知X的分子式是C15H18N2O5,D错误;
故合理选项是BD;
(5)D+F→G的化学方程式为: ;
;
(6)化合物A(C8H7NO4)的同分异构体同时符合下列条件:①分子是苯的二取代物,1H-NHR谱表明分子中有4种化学环境不同的氢原子,存在对称结构;②分子中存在硝基和酯基结构,2个取代基可能结构为:-NO2与-CH2OOCH、-NO2与-CH2COOH、-COOH与-CH2NO2、-OOCH与-CH2NO2,同分异构体可能结构简式为![]() 、
、![]() 、
、![]() 、
、![]() 。
。
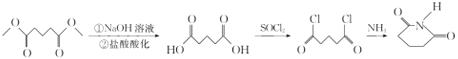
(7)由E(CH3OOCCH2CH2CH2COOCH3)先在NaOH溶液中发生水解反应,然后酸化可得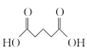 ,该物质与SOCl2发生反应产生
,该物质与SOCl2发生反应产生![]() ,
,![]() 与NH3发生反应得到目标产物
与NH3发生反应得到目标产物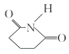 ,故由E合成
,故由E合成 的路线为:
的路线为: 。
。


科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
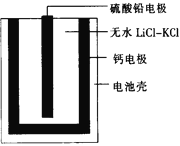
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论,雅礼中学化学研究性小组进行以下实验:
资料:i. 草酸(H2C2O4)为二元弱酸。
ii. 三水三草酸合铁酸钾[K3Fe(C2O4)33H2O]为翠绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O为黄色固体,溶于水,可溶于强酸。
(实验1)用以下装置制取无水氯化亚铁
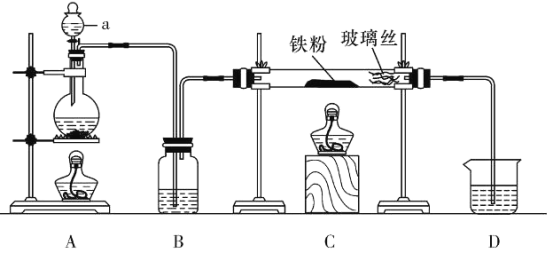
(1)仪器a的名称为___________。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________。
(3)若用D的装置进行尾气处理,存在的问题是__________、___________。
(实验2)通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。

(4)取实验2中少量晶体洗浄,配成溶液,漓加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______________。
(5)经检验,翠绿色晶体为K3Fe(C2O4)33H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是_____。
(6)取实验2中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
(实验3)研究性小组又设计以下装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
(7)描述达到期目的可能产生的现象:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________。
②MgCO3分解温度比CaCO3低的原因是___________。
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有![]() 键的数目为________。
键的数目为________。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ),C为(
),C为(![]() );则D原子的坐标参数为________。
);则D原子的坐标参数为________。
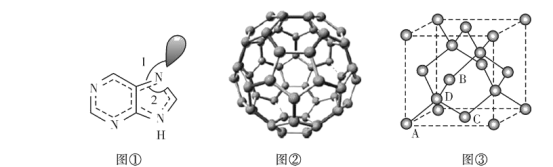
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图①所示,其中(〇为Se,●为Mn),则Se的配位数为____,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为![]() g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
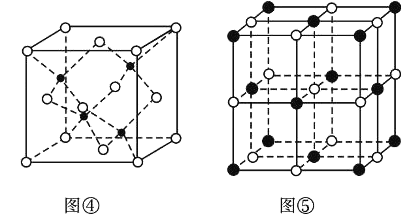
(7)KI的晶胞结构如图⑤所示,已知其晶体的密度为![]() g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化。已知B分子组成中z原子个数比C分子中多一个。

请回答下列问题:
(1)元素x的原子结构示意图___;元素y在周期表中的位置是___;
(2)写出单质氟与C反应的离子反应方程式:___。
(3)Y与X在一定条件下生成化合物A的化学方程式:___。
(4)一定条件下,将盛有10mLA的大试管倒置于水槽的水中然后缓缓通入Y至液体刚好充满试管,写出反应的化学方程式___;通入相同状况下气体Y的体积为___。
(5)用电子式表示B的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
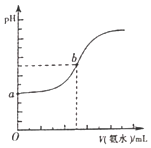
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是
A.除去淀粉溶液中的NaCl 
B.比较NaHCO3和Na2CO3的热稳定性
C.制备Fe(OH)2 
D.测定过氧化钠的纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com