
【题目】一种芳纶纤的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图所示:
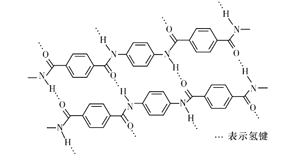
下列关于该高分子的说法不正确的是
A. 芳纶纤维可用作航天、航空、国防等高科技领域的重要基础材料
B. 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C. 氢键对该高分子的性能有影响
D. 结构简式为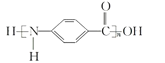
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
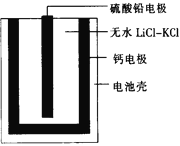
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:
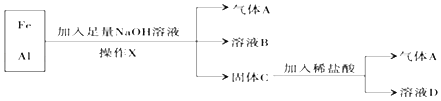
(1)操作X的名称是_____;
(2)气体A是_____ (填化学式 );
(3)加入足量NaOH溶液时发生反应的离子方程式为:_____;加入稀盐酸发生反应的离子方程式为:_____;
(4)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(![]() ),环己二烯(
),环己二烯(![]() )和苯的氢化热数据:
)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ·mol-1) | ﹣119.7 | ﹣232.7 | ﹣208.4 |
根据表中数据推断正确的是( )
A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈
B.环己烯、环己二烯和苯都含有相同的官能团
C.环己烯、环己二烯和苯相比较,苯最稳定
D.上述条件下,lmol![]() 转变为
转变为![]() 时吸收热量
时吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标况下,16gCH4含有分子数目为NA个
B.0.1 mol·L1氯化钠溶液含有的Na+数目为0.1NA
C.1 molH2O中含有质子数为10NA个
D.标况下,22.4L空气中含有分子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
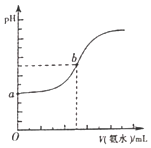
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com