
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关计算正确的是
A.现有CO、CO2、O3三种气体,分别都含有1molO,则三种气体的物质的量之比为3∶2∶1
B.ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为![]()
C.标准状况下,11.2LX气体分子的质量为16g,则X气体的摩尔质量是32
D.4℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为![]()
【答案】B
【解析】
A.CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=![]() mol,n(O3)=
mol,n(O3)=![]() mol,则这三种气体的物质的量之比为1:
mol,则这三种气体的物质的量之比为1: ![]() :
:![]() =6:3:2,故A错误;
=6:3:2,故A错误;
B.ngCl2的物质的量为![]() mol,所含氯原子数为:
mol,所含氯原子数为:![]() ×2NA,则有
×2NA,则有![]() mol×2NA=m,则阿伏加德罗常数NA的数值可表示为
mol×2NA=m,则阿伏加德罗常数NA的数值可表示为![]() ,故B正确;
,故B正确;
C.标准状况下,11.2LX气体的物质的量为![]() =0.5mol,质量为16g,
=0.5mol,质量为16g,![]() =32gmol1,摩尔质量的单位是gmol1,所以X气体的摩尔质量是32gmol1,故C错误;
=32gmol1,摩尔质量的单位是gmol1,所以X气体的摩尔质量是32gmol1,故C错误;
D.4℃时,1mL水的质量是1g,20滴水恰好为1mL,那么1滴水的质量是0.05g,1滴水中所含的水分子数N=nNA=![]() NA=
NA=![]() ×NA/mol=
×NA/mol=![]() ,故D错误;
,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
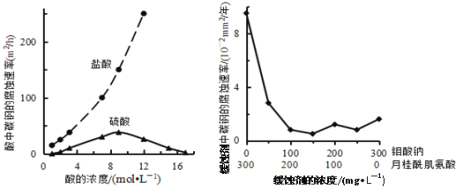
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(![]() ),环己二烯(
),环己二烯(![]() )和苯的氢化热数据:
)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ·mol-1) | ﹣119.7 | ﹣232.7 | ﹣208.4 |
根据表中数据推断正确的是( )
A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈
B.环己烯、环己二烯和苯都含有相同的官能团
C.环己烯、环己二烯和苯相比较,苯最稳定
D.上述条件下,lmol![]() 转变为
转变为![]() 时吸收热量
时吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法错误的是( )
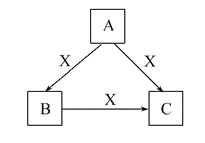
A. 若X为Cl2,则C可能为FeCl3
B. 若X为KOH溶液,则A可能为AlCl3
C. 若X为O2,则A可能为硫化氢
D. 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论,雅礼中学化学研究性小组进行以下实验:
资料:i. 草酸(H2C2O4)为二元弱酸。
ii. 三水三草酸合铁酸钾[K3Fe(C2O4)33H2O]为翠绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O为黄色固体,溶于水,可溶于强酸。
(实验1)用以下装置制取无水氯化亚铁
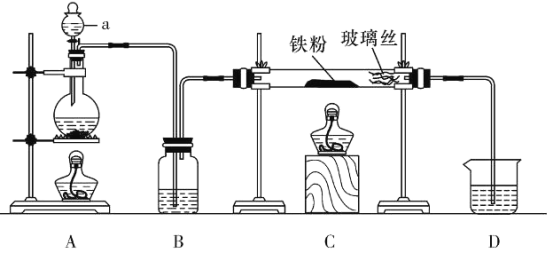
(1)仪器a的名称为___________。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________。
(3)若用D的装置进行尾气处理,存在的问题是__________、___________。
(实验2)通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。

(4)取实验2中少量晶体洗浄,配成溶液,漓加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______________。
(5)经检验,翠绿色晶体为K3Fe(C2O4)33H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是_____。
(6)取实验2中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
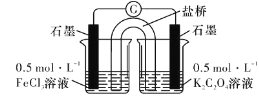
(实验3)研究性小组又设计以下装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
(7)描述达到期目的可能产生的现象:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化。已知B分子组成中z原子个数比C分子中多一个。

请回答下列问题:
(1)元素x的原子结构示意图___;元素y在周期表中的位置是___;
(2)写出单质氟与C反应的离子反应方程式:___。
(3)Y与X在一定条件下生成化合物A的化学方程式:___。
(4)一定条件下,将盛有10mLA的大试管倒置于水槽的水中然后缓缓通入Y至液体刚好充满试管,写出反应的化学方程式___;通入相同状况下气体Y的体积为___。
(5)用电子式表示B的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com