
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法错误的是( )
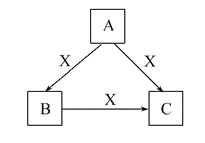
A. 若X为Cl2,则C可能为FeCl3
B. 若X为KOH溶液,则A可能为AlCl3
C. 若X为O2,则A可能为硫化氢
D. 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】研究不同条件对相同体积相同物质的量浓度的 H2O2分解速率的影响,得到如下数据。由此不能得出的结论是:
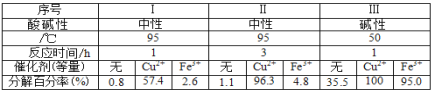
A. Cu2+与 Fe3+对 H2O2 分解都有催化作用,但 Cu2+催化效果更好
B. 由Ⅰ与Ⅱ可知其它条件相同时,时间越长, H2O2 分解越彻底
C. 由Ⅰ与Ⅲ可知其它条件相同时,温度越高, H2O2 分解越快
D. 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强, H2O2 分解越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年我国女科学家屠呦呦因“发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得有诺贝尔奖“风向标”之誉的拉斯克临床医学奖。青蒿素结构式如图所示。已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”。下列有关青蒿素的说法不正确的是( )

A.青蒿素分子有6个手性碳原子
B.青蒿素的化学式为:C15H22O5
C.青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D.青蒿素是脂溶性的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,遇水能强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2·2H2O,工艺流程如下:
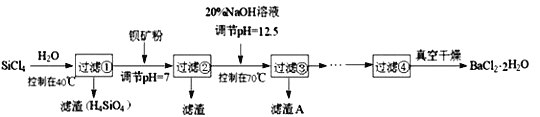
已知:
① 常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244。
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为______________________________________________
(2)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol电子转移时吸收59 kJ热量,则该反应的热化学方程式为__________________________________________________________
(3)加钡矿粉并调节pH=7的目的是①______________________,②______________________
(4)过滤②后的滤液中Fe3+浓度为_______________(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)。
(5)生成滤渣A的离子方程式________________________________________
(6)BaCl2滤液经___________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关计算正确的是
A.现有CO、CO2、O3三种气体,分别都含有1molO,则三种气体的物质的量之比为3∶2∶1
B.ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为![]()
C.标准状况下,11.2LX气体分子的质量为16g,则X气体的摩尔质量是32
D.4℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅文献:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价氮的化合物。
Ⅱ.FeSO4 + NO![]() Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。
甲按照如图所示的实验装置进行实验:
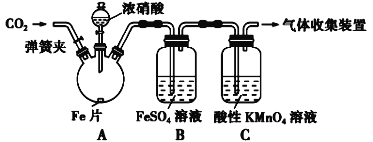
实验操作和现象记录如表所示:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞 | 无明显现象 |
加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余 |
请回答下列问题:
① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是________________________________
② 检验是否生成-3价氮的化合物,应进行的实验操作是________________________________
③ 甲取少量B中溶液,加热,实验现象是____________________________________________,请用化学平衡原理解释原因________________________________________________________,甲依据该现象得出结论:铁与硝酸反应有NO生成。
④乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是____________________________,证明有NO生成的实验现象是________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__、其中6Li、7Li互为__,用电子式表示Li2O的形成过程___。
(2)金属钾19K位于元素周期表中的第__周期、第__族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___;超氧化钾与水反应如下,请配平该反应的化学方程式:
_KO2+_H2O=_KOH+_O2↑+_H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__、可作半导体材料的元素是__(填名称),当反应H2+Cl2![]() 2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.①③④B.②③C.①④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com