
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
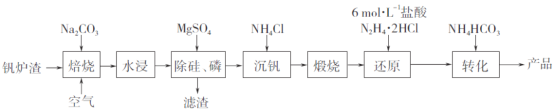
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
【答案】V2O3+Na2CO3+O2![]() 2NaVO3+CO2 Mg3(PO4)2、MgSiO3 0.8 N2H42HCl+2V2O3+6HCl=4VOCl2+N2↑+6H2O 有氯气生成,污染空气 将VO2+氧化为VO2+
2NaVO3+CO2 Mg3(PO4)2、MgSiO3 0.8 N2H42HCl+2V2O3+6HCl=4VOCl2+N2↑+6H2O 有氯气生成,污染空气 将VO2+氧化为VO2+ ![]() 偏高
偏高
【解析】
钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质),加入碳酸钠通入空气焙烧,产物加水溶解,向溶液中加入硫酸镁除去硅磷过滤,滤渣的主要成分为Mg3(PO4)2、MgSiO3.滤液中加入氯化铵沉钒生成NH4VO3,其受热分解生成V2O5,再用盐酸酸化的N2H42HCl还原V2O5生成VOCl2,最后再向反应后溶液中加入NH4HCO3,即可得到产品氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O];
(5)①测定氧钒碱式碳酸铵晶体粗产品中钒的含量的原理为:氧钒碱式碳酸铵晶体溶解后,加0.02mol/LKMnO4溶液至稍过量,氧化其中+4价钒为VO2+,再加入NaNO2溶液除去过量的KMnO4,防止后续对标准液的消耗干扰试验,最后用(NH4)2Fe(SO4)2标准溶液滴定VO2+;
②根据钒元素的质量守恒,根据滴定反应为:VO2-+Fe2++2H+=VO2++Fe3++H2O,则钒元素的物质的量n=n((NH4)2Fe(SO4)2)=cmol/L×b×10-3L=cb×10-3mol,据此计算;
③若(NH4)2Fe(SO4)2标准溶液部分变质,则还原能力降低,滴定时消耗的标准液体积偏高,由此判断误差;
(1)将钒炉渣和碳酸钠在空气流中焙烧将V2O3转化为可溶性NaVO3,同时得到二氧化碳,发生反应的化学方程式为V2O3+Na2CO3+O2![]() 2NaVO3+CO2;
2NaVO3+CO2;
(2)焙烧时SiO2、P2O5分别与碳酸钠生成可溶于水的Na2SiO3和Na3PO4,除硅、磷时加入硫酸镁溶液生成Mg3(PO4)2、MgSiO3沉淀,则过滤时得到的滤渣的主要成分为Mg3(PO4)2、MgSiO3;
(3)已知Ksp(NH4VO3)=c(NH4+)c(VO3-)=1.6×10-3, 若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,则溶液中剩余c(VO3-)=0.1mol·L-1×2%=0.002 mol·L-1,此时c(NH4+)=![]() mol·L-1=0.8mol·L-1;
mol·L-1=0.8mol·L-1;
(4)用盐酸酸化的N2H42HCl还原V2O5生成VOCl2和一种无色无污染的气体,根据质量守恒定律,此气体应为N2,则发生反应的化学方程式为N2H42HCl+2V2O3+6HCl=4VOCl2+N2↑+6H2O;若改用浓盐酸与V2O5反应也可以制得VOC12,但同时得到的氧化产物为Cl2,此气体有毒,会污染环境;
(5)①根据分析,KMnO4溶液的作用是将+4价的钒氧化为VO2+;
②根据钒元素的质量守恒,根据滴定反应为:VO2-+Fe2++2H+=VO2++Fe3++H2O,则钒元素的物质的量n=n[(NH4)2Fe(SO4)2]=cmol/L×b×10-3L=cb×10-3mol,粗产品中钒的质量分数的表达式为![]()
![]() ;
;
③若(NH4)2Fe(SO4)2标准溶液部分变质,则还原能力降低,滴定时消耗的标准液体积偏高,根据滴定反应为:VO2-+Fe2++2H+=VO2++Fe3++H2O,可知会使测定结果偏高。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________。
②MgCO3分解温度比CaCO3低的原因是___________。
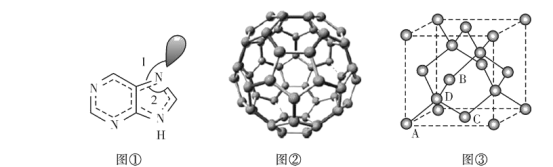
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有![]() 键的数目为________。
键的数目为________。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ),C为(
),C为(![]() );则D原子的坐标参数为________。
);则D原子的坐标参数为________。
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图①所示,其中(〇为Se,●为Mn),则Se的配位数为____,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为![]() g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
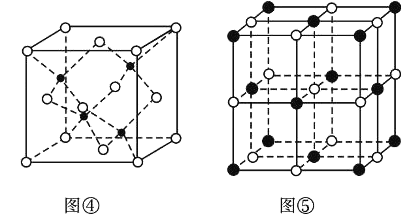
(7)KI的晶胞结构如图⑤所示,已知其晶体的密度为![]() g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
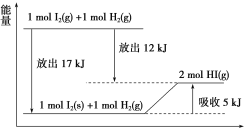
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
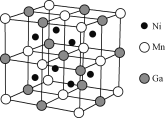
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是
A.除去淀粉溶液中的NaCl 
B.比较NaHCO3和Na2CO3的热稳定性
C.制备Fe(OH)2 
D.测定过氧化钠的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
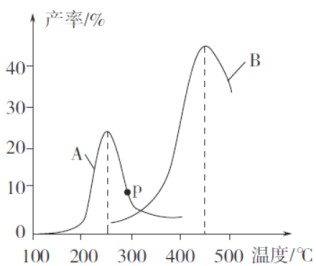
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
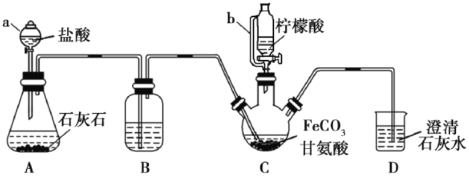
查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是_______________。
(2)装置B中盛有的试剂是:____________;装置D的作用是________________。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为____________________________。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
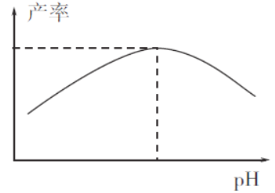
①pH过低或过高均导致产率下降,其原因是_____________________;
②柠檬酸的作用还有________________________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法正确的是:

A.过程Ⅰ的反应为6FeO+O2![]() 2Fe3O4
2Fe3O4 ![]()
B.过程Ⅱ中H2为还原剂
C.整个过程的总反应为:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.FeO是过程Ⅰ的氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的分子结构也可用键线式表示为:![]() ,有机物A的键线式为
,有机物A的键线式为![]() ,A可由有机物B与等物质的量氢气通过加成反应得到。
,A可由有机物B与等物质的量氢气通过加成反应得到。
(1)有机物A的分子式为___________。
(2)有机物A的名称是_______________。
(3)在A 的主链为5个C原子的所有同分异构体中,其分子结构中含有3个甲基的有机物的名称是_______________。
(4)有机物B可能的结构简式有![]() 、_______________、_______________、_______________、_______________。
、_______________、_______________、_______________、_______________。
(5)请写出![]() 在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com