
【题目】A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置_____________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_____。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_____;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_____。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式___。
【答案】第三周期ⅠA族 S2-->O2--->Na+ 离子键和共价键 Fe2O3+2Al![]() 2Fe+Al2O3 SiO2+2OH--===SiO32-+H2O 2SO2+O2+2H2O===2H2SO4
2Fe+Al2O3 SiO2+2OH--===SiO32-+H2O 2SO2+O2+2H2O===2H2SO4
【解析】
C元素的原子最外层电子数是次外层电子数的三倍,根据核外电子排布规律,推出C为O,C与F同主族,即F为S,都是短周期元素,D是所在周期原子半径最大的主族元素,四种元素原子序数依次增大,即D为Na,A与D同主族,即A为H,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,Na和S之间的单质没有气体,即B为N,据此分析;
C元素的原子最外层电子数是次外层电子数的三倍,根据核外电子排布规律,推出C为O,C与F同主族,即F为S,都是短周期元素,D是所在周期原子半径最大的主族元素,四种元素原子序数依次增大,即D为Na,A与D同主族,即A为H,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,Na和S之间的单质没有气体,即B为N,
(1)D元素为Na,位于周期表中第三周期IA族;
答案为第三周期IA族;
(2)三种元素形成简单离子是O2-、Na+、S2-,离子半径大小顺序是S2->O2->Na+;
答案为S2->O2->Na+;
(3)按照原子个数比,化学式为H4N2O3,即NH4NO3,硝酸铵属于离子化合物,是由NH4+和NO3-组成,即含有化学键为离子键和极性共价键;
答案为离子键和极性共价键;
(4)E为金属元素,按照元素周期表,推出E为Al,利用Al的还原性强,与氧化铁发生:2Al+Fe2O3 ![]() 2Fe+Al2O3,E是非金属元素,其单质在电子工业中有重要的应用,即E元素为Si,SiO2属于酸性氧化物,与强碱反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
2Fe+Al2O3,E是非金属元素,其单质在电子工业中有重要的应用,即E元素为Si,SiO2属于酸性氧化物,与强碱反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
答案为2Al+Fe2O3 ![]() 2Fe+Al2O3;SiO2+2OH-=SiO32-+H2O;
2Fe+Al2O3;SiO2+2OH-=SiO32-+H2O;
(5)FC2为SO2,SO2以还原性为主,与氧气、水蒸气反应的化学方程式为2SO2+O2+2H2O=2H2SO4;
答案为2SO2+O2+2H2O=2H2SO4。


科目:高中化学 来源: 题型:
【题目】下表代表周期表中的几种短周期元素,下列说法中错误的是
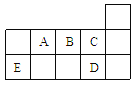
A. ED4分子中各原子均达8电子结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. A、B、C第一电离能的大小顺序为C>B>A
D. C、D气态氢化物稳定性强弱和沸点高低均为C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是
A. 区分晶体和非晶体最可靠的科学方法是对固体进行 X射线衍射
B. 离子键、金属键无方向性和饱和性,而所有共价键都有方向性和饱和性
C. 处于能量最低状态时,外围电子排布为4d15s2的某元素原子,M能层共有8个电子,该元素位于![]() 区第ⅢB族
区第ⅢB族
D. 对充有氖气的霓虹灯管通电,灯管发出红色光.产生这一现象的主要原因是电子由基态向激发态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A. +412 kJ·mol-1B. -412 kJ·mol-1C. +236 kJ·mol-1D. -236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④12C、14C
(1)互为同位素的是______(填序号,下同);
(2)互为同素异形体的是_____;
(3)氢的三种原子1H、2H、3H与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有___种;
Ⅱ、用化学用语回答下列问题:
(1)写出NaOH的电子式____;
(2)用电子式表示二氧化碳分子的形成过程_________;
Ⅲ、下列物质:①N2 ②H2O2 ③NH3 ④Na2O ⑤NH4Cl
(1)含有极性键和非极性键的是_______(填序号,下同);
(2)含有极性键的离子化合物是_________;
(3)氟化氢水溶液中存在的氢键有________种;
(4)分子(CN)2分子中每个原子最外层均满足8电子稳定结构,其结构式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
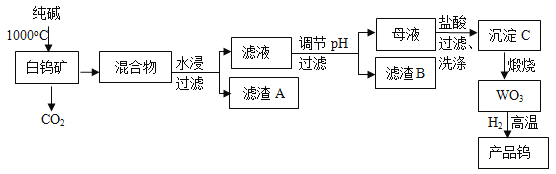
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
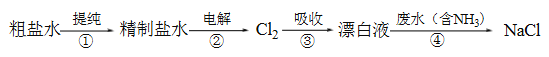
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________(用元素符号表示);
(2)X与水反应的化学方程式是______________;
(3)X中一种元素对应的单质,可与石灰乳反应得到漂白粉,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
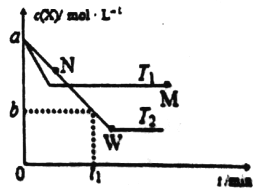
A. M点的正反应速率v正大于N点的逆反应速率v逆
B. T2下在0—t1min时间内v(Y)=a-b/t1mol·L-1·min-1
C. 该反应进行到M点放出的热量大于进行到W点放出的热量
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com