
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
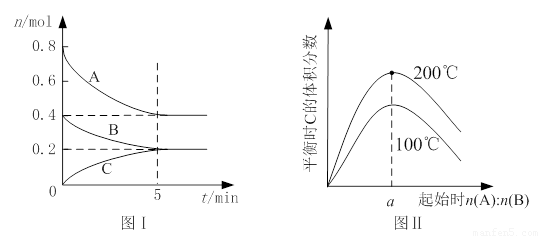
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
AD
【解析】
试题分析:根据图1可知,平衡时B的物质的量减少了0.4mol-0.2mol=0.2mol,所以用物质B表示的反应速率是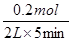 =0. 02 mol·L-1·min-1,A正确;题意根据图1可知,平衡时A的物质的量减少了0.4mol,C的物质的量增加了0.2mol,所以该反应的化学方程式是2A(g)+B(g)
=0. 02 mol·L-1·min-1,A正确;题意根据图1可知,平衡时A的物质的量减少了0.4mol,C的物质的量增加了0.2mol,所以该反应的化学方程式是2A(g)+B(g) C(g)。根据图2可知,温度越高,C的含量越高,这说明升高温度平衡向正反应方向移动,则正方应是吸热反应,B不正确;容器容积不变,则再向体系中充入He,体系压强增大,但,反应速率不变,平衡不移动,C不正确;D中200℃时,向容器中充入2 mol A 和1 mol B,相当于是在原平衡的基础上增大压强,平衡向正反应方向移动,所以反应物A的转化率增大,含量降低,D正确,答案选AD。
C(g)。根据图2可知,温度越高,C的含量越高,这说明升高温度平衡向正反应方向移动,则正方应是吸热反应,B不正确;容器容积不变,则再向体系中充入He,体系压强增大,但,反应速率不变,平衡不移动,C不正确;D中200℃时,向容器中充入2 mol A 和1 mol B,相当于是在原平衡的基础上增大压强,平衡向正反应方向移动,所以反应物A的转化率增大,含量降低,D正确,答案选AD。
考点:考查反应速率的计算、外界条件对平衡状态的影响以及图像识别等
点评:该题是高考中的常见题型,属于综合性试题的考查,侧重对学生解题能力的培养,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013届浙江省杭州市高三上学期期中七校联考化学试卷(带解析) 题型:填空题
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: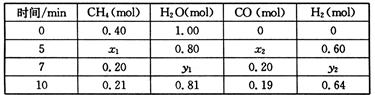
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省如皋中学高二上学期质量检测化学试卷(理化班) 题型:计算题
(10分)已知几种共价键的键能数据如下:
| 共价键 | N≡N | H-H | N-H |
| 键能/(kJ·mol-1) | 946 | 436 | 390.8 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
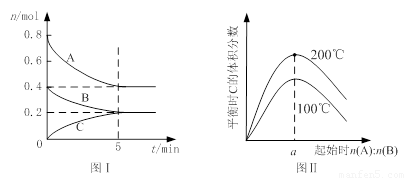
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数大于0.5
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
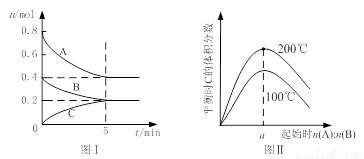
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期第三次月考化学试卷(普) 题型:填空题
(12分)合成氨对化学工业和国防工业具有重要意义。
⑴向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
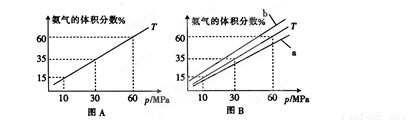
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=500℃,则温度为450℃时对应的曲线是 (填“a”或“b”)。
⑵合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
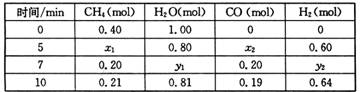
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),
前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com