
����Ŀ��һ���ܱ��������м���һ�����ɻ����ĸ��壨��Ȳ��ƣ��������ֳ������֣�����߳���8molN2���ұ߳���CO��CO2�Ļ�����干64gʱ�����崦����ͼλ�ã������¶Ȳ��䣩������˵����ȷ����
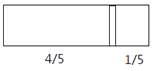
A.�ұ�CO��CO2������֮��Ϊ1:3
B.�ұ�CO������Ϊ14g
C.�ұ������ܶ�����ͬ�����������ܶȵ�2��
D.���ı��ұ�CO��CO2�ij�������ʹ���崦�ھ����Ҷ�1/3 �����������¶Ȳ��䣬��ǰ�����������ڵ�ѹǿ֮��Ϊ5:6
���𰸡�D
��������
��֪���ܱ��������м��������ɻ��������������������¶ȡ�ѹǿ��ͬ������ͬ�¡�ͬѹ�£���������֮�ȵ������ʵ���֮�ȣ��ݴ˼����Ҳ�CO��CO2�������ʵ������ٽ��CO��CO2������������CO��CO2�����ʵ������ݴ˽��
��֪���ܱ��������м��������ɻ��������������������¶ȡ�ѹǿ��ͬ������ͬ�¡�ͬѹ�£���������֮�ȵ������ʵ���֮�ȣ������������֮��Ϊ4:1����֪���������������ʵ���֮��Ϊ4:1�������Ҳ�CO��CO2�������ʵ���=![]() ����CO��CO2������Ϊ64g����CO�����ʵ���Ϊxmol���������̼���ʵ���Ϊ(2x)mol��28xg+44(2x)g=64g�����x=1.5mol����CO�����ʵ���Ϊ1.5mol��������̼���ʵ���Ϊ0.5mol��
����CO��CO2������Ϊ64g����CO�����ʵ���Ϊxmol���������̼���ʵ���Ϊ(2x)mol��28xg+44(2x)g=64g�����x=1.5mol����CO�����ʵ���Ϊ1.5mol��������̼���ʵ���Ϊ0.5mol��
A. ������������ʵ���֮�ȵ����������֮�ȣ���֪�ұ�CO��CO2������֮��Ϊ1.5mol:0.5mol=3:1����A����
B. m(CO)=n(CO)M(CO)=1.5mol��28g/mol=42g����B����
C. ��ͬ�����£������ܶ�֮�ȵ�����Ħ������֮�ȣ��ұ������ƽ��Ħ������![]() ��������Ħ��������ȣ���C����
��������Ħ��������ȣ���C����
D. ���ı��ұ�CO��CO2�ij�������ʹ���崦�ھ����Ҷ�![]() �����������������֮��Ϊ2:1������CO��CO2���ʵ���Ϊ4mol������ͬ�¡�ͬ�ݻ��£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�������ѹǿ֮��Ϊ(8+2)mol:(8+4)mol=5:6����D��ȷ��
�����������������֮��Ϊ2:1������CO��CO2���ʵ���Ϊ4mol������ͬ�¡�ͬ�ݻ��£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�������ѹǿ֮��Ϊ(8+2)mol:(8+4)mol=5:6����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ������У���ȷ����(����)
A.ȡ��ҩƷ B.���������̼
B.���������̼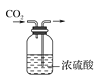
C.�ⶨij��Һ��pH 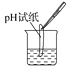 D.�μ�Һ��
D.�μ�Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ�������й�������ȷ����(����)
A.0.1 mol C2H6O�����к���C��H����Ϊ0.5NA
B.0.1 mol Cl2��0.1 mol HI��ַ�Ӧ�����������Ϊ0.2NA
C.CO2ͨ��Na2O2ʹ������2.8 g����Ӧ��ת�Ƶ�����Ϊ0.2NA
D.3.0 g��ȩ(HCHO)������Ļ�����к��е�ԭ������Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã�����K�պ�ʱ��������ָ�뷢��ƫת�������йؿ���K�պ�ʱ��˵����ȷ����(����)
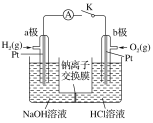
A.b���Ǹ���
B.a���缫��ӦʽΪH2��2e��===2H��
C.��װ������1 mol����ͨ��ʱ���ҳز�����״����5.6 L����
D.����ܷ�ӦʽΪ2H2��O2===2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�������Ϊ2.0 L�ĺ����ܱ������У���ӦCO2(g)��C(s)![]() 2CO(g)��H>0���ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
2CO(g)��H>0���ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
���� | �¶�/K | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K���÷�Ӧ�Ļ�ѧƽ�ⳣ��ֵΪ2
B.�ﵽƽ��ʱ��������I������C������ƽ�������ƶ�
C.�ﵽƽ��ʱ����������CO2��ת���ʱ��������еĴ�
D.�ﵽƽ��ʱ���������е�CO��ת���ʴ���28.6%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊֹ��ú����������ʹ�õ���Ҫ��Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ͼ����úΪԭ�Ϻϳɾ۱���ϩ���ϵ����̡�
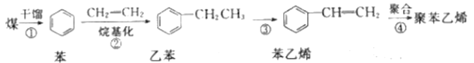
��1������һ��������Cl2��Ӧ������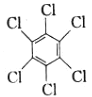 ���÷�Ӧ����Ϊ___������ȡ���������ӳ�������Ӧ��
���÷�Ӧ����Ϊ___������ȡ���������ӳ�������Ӧ��
��2����ͼ������ԭ��������Ϊ100%�ķ�Ӧ��___(����ĸ����
A.�٢� B.�ڢ�
��3����ʹ���Ը��������Һ��ɫ����___(����![]() ������
������![]() ��)��
��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2+3H2��2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�� �� ��
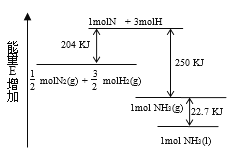
A.![]() N2(g)+
N2(g)+![]() H2(g)�� NH3(l) ��H=-46kJ/mol
H2(g)�� NH3(l) ��H=-46kJ/mol
B.![]() N2(g)+
N2(g)+ ![]() H2(g)�� NH3(g) ��H=-454kJ/mol
H2(g)�� NH3(g) ��H=-454kJ/mol
C.N2(g)+3H2(g)��2NH3(g) ��H=-92kJ/mol
D.N2(g)+3H2(g)��2NH3(1) ��H= +431.3kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ���װ����ͼ��ʾ������ܷ�ӦΪ2Ag��Cl2��2AgCl������˵����ȷ����

A. ������ӦΪAgCl ��e����Ag ��Cl��
B. �ŵ�ʱ������Ĥ�Ҳ���Һ���д�����ɫ��������
C. ����NaCl��Һ�������ᣬ�����ܷ�Ӧ��֮�ı�
D. ����·��ת��0.01 mol e��ʱ������Ĥ�����Һ��Լ����0.02 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������Լ�ʵ��������ȫһ�µ��ǣ� ��
A | ������ͭ��Һ�м���һС������� | �к�ɫ�������� |
B | ��̼������Һ��ͨ����� | �а�ɫ�������� |
C | �����Ƶ���ˮ�ε���ɫʯ����ֽ�� | ��ֽ��� |
D | ����ɰֽ��ĥ�����������ھƾ��ƻ����ϼ��� | ���ۻ����������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com