
����Ŀ����ͼ�г��ˢ١������Ԫ�������ڱ��е�λ�ã� 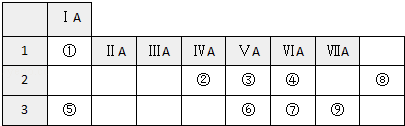
�밴Ҫ��ش��������⣮
��1��Ԫ�آ�������� �� Ԫ�آ������ڱ�������λ�� �� Ԫ�آܵ��⻯��е���ڢߵ��⻯��е㣬ԭ���� ��
��2���ܢޢߵ��⻯�ﰴ�ȶ���������ǿ��˳������д�⻯��Ļ�ѧʽ����
��3��Ԫ�آڢ��γ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ĵ���ʽ�� ��
��4��Ԫ�آ��γɵ�һ���⻯���Ϊ������ͨʽ�� �� �����������ʽ��������ͬ���칹�壬�ṹ��ʽ�ֱ��� ��
��5���õ���ʽ��ʾ������γɻ�����Ĺ��� ��
���𰸡�
��1���ʣ��ڶ�����0�壻H2O���Ӽ����γ����
��2��PH3��H2S��H2O
��3��![]()
��4��CnH2n+2��C4H10��CH3CH2CH2CH3��CH3CH��CH3��CH3
��5��![]()
���������⣺��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪP����ΪS����ΪNe����ΪCl��
��1.������������ʣ�λ�ڵڶ�����0�壬Ԫ�آ�Ϊ����Ԫ�آܵ��⻯��е���ڢߵ��⻯��е㣬ԭ����H2O���Ӽ����γ���������Դ��ǣ��ʣ��ڶ�����0�壻H2O���Ӽ����γ������
��2.��ͬ����������ҷǽ�������ǿ��ͬ�������϶��·ǽ����Լ������ʷǽ�����O��S��P���ǽ�����Խǿ���⻯��Խ�ȶ������⻯���ȶ��ԣ�PH3��H2S��H2O�����Դ��ǣ�PH3��H2S��H2O��
��3.��Ԫ�آڢ��γ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ΪCO2 �� �����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��4.��Ԫ�آ��γɵ�һ���⻯���Ϊ������ͨʽ��CnH2n+2 �� ����C4H10������ͬ���칹�壬�ṹ��ʽ�ֱ���CH3CH2CH2CH3��CH3CH��CH3��CH3 �� ���Դ��ǣ�CnH2n+2��C4H10��CH3CH2CH2CH3��CH3CH��CH3��CH3��
��5.��������γɻ�����ΪNa2S���������ӻ�������������������ӹ��ɣ���Naԭ�ӡ�Sԭ�ӵ���ʽ��ʾ���γɹ���Ϊ ![]() ��
��
���Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ H2 ���Ʒ�Ӧ�Ʊ��⻯�Ƶ�װ������ͼ��ʾ��Zn ���к������� ZnS ���ʣ�������˵������ȷ����

A. ���� ��������ʢ��Ũ NaOH ��Һ�� Ũ H2SO4
B. ��ʽ¯����ǰ�� ���Թ��ռ��۴����岢��ȼ�� ͨ�������ж����崿��
C. ������Ӧʱ�� ��ֹͣ��ʽ¯���ȣ� �ٹرջ��� K
D. ȡ�������ڵĹ��壬 Ͷ������ˮ�У� ������������� ����֤���Ƶ����⻯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�������ȷ�Ӧ����( )
A. п��Ͷ��ϡ�����в������� B. ��ʯ������ˮ
C. ����к� D. Ba(OH)2��8H2O��NH4Cl������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�ϩΪԭ�Ϻϳɿ���ҩ��D�ͻ���������ǿ�Ƽ���ĺϳ�·������(���ַ�Ӧ�����Ͳ��Z����ȥ)��
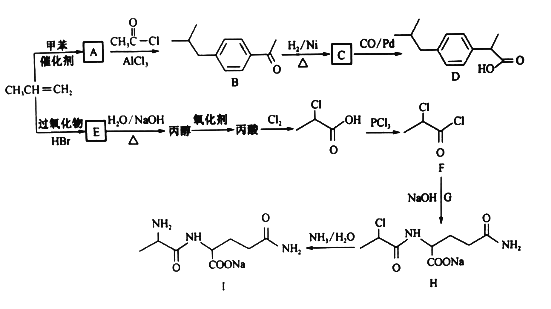
��֪�� +HCl
+HCl
�ش��������⣺
��1��A�Ľṹ��ʽ________����H����I�ķ�Ӧ����Ϊ______________��
��2��E������Ϊ_____________��
��3��������G�Ļ�ѧʽΪC5H10O3N2������ṹ��ʽΪ___________________��
��4����E���ɱ�ϩ�Ļ�ѧ����ʽΪ __________________________________��
��5������ʽΪC9H10O2���л���J��D��ͬϵ�J�Ľṹ����________�֡�
��6��������������е���Ϣ���������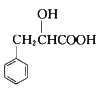 �Ʊ�
�Ʊ�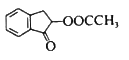 �ĺϳ�·�ߣ�_________________���������Լ���ѡ��
�ĺϳ�·�ߣ�_________________���������Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA (g) + bB (s) ![]() cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
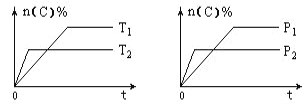
A. �¶Ƚ��ͣ���ѧƽ�����淴Ӧ�����ƶ�
B. ʹ�ô�����C�����ʵ�����������
C. ��ѧ����ʽϵ��a ��c��d
D. ������ͼ��ȷ���ı��¶Ⱥ�ѧƽ���ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Ȼ��ͭ����Ҫ�ɷ�ΪCuFeS2 ����SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ�������ͼ1ʵ�飺

��ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���գ�����Cu��Fe2O3 ��FeO��SO2���壬ʵ���ȡd����Һ��1/5������ƿ�У���0.01mo1/L������Һ���еζ���������Ϊ0.10mL��ĩ������ͼ2��ʾ�����������գ�
��1��װ��c��������____________________________��
��2��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����_____________________��
��3���ζ�ʱ��������Һ�������Ϊ_____mL���û�ѧ����ʽ��ʾ�ζ���ԭ����________________________________________��
��4������û�ͭ��Ĵ���___________________��
��5����ҵ�����û�ͭ��ұ��ͭ������¯������Fe2O3 ��FeO��SiO2��Al2O3�����Ʊ�Fe2O3��
ѡ���ṩ���Լ������ʵ����֤¯���к���FeO��
�ṩ���Լ���ϡ���� ϡ���� KSCN��Һ KMnO4��Һ NaOH��Һ
��ѡ�Լ�Ϊ_________��֤��¯���к���FeO��ʵ������Ϊ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �����£��ֱ���2 mL ��0.1 mol/L HCl��0.1 mol/L CH3COOH��Һ��Ͷ������þ����
��1����Ӧǰ����Һ��pH��pH(����) _______ pH(����)��ѡ����>������<������=��������2����ͬ����
��2����ʼʱ��þ����Ӧ�����ʣ�v(����) ________v(����)��
��3�������������������ʵ���������________������
��4����Ӧǰ������c(OH-)=_________mol/L��
II. �ֱ���2 mL ������Ũ����Ϊ0.1 mol/L�������������Һ��Ͷ��������þ����
��5����ʼʱ��þ����Ӧ�����ʣ�v(����)_____v(����)��ѡ������>������<������=��������2����ͬ����
��6����������ʼ�����ʵ���Ũ�ȣ�c(����) ______c(����)��
��7���������������ĵ����ʵ���������______������
III. ��֪������H3PO2��һԪ���ᣬ20�� ʱ�ĵ��볣��K �� 0.1��
��8��д�����ĵ��뷽��ʽ______________________________��
��9��д��K�ı���ʽ��K=________, 0�� ʱ��0.2 mol/L H3PO2��Һ��pH =_____��ƽ��ʱc(H3PO2)�������ƴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������һ��2L���ܱ�������������4 molA��2molB�������·�Ӧ��
3A(g)+2B(g)![]() 4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
A. ǰ2min��D��ƽ����Ӧ����Ϊ0.2mol/(L��min)
B. ��ʱ��B��ƽ��ת������40��
C. ����B��ƽ�������ƶ���B��ƽ��ת��������
D. �������ϵ��ѹǿ��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�Ӧ��ѧ��Ӧ�����ӷ���ʽ����ȷ����
A. ��������ˮ��Cl2+H2O=2H++Cl-+ClO-
B. ��NaAlO2��Һ��ͨ�������CO2��AlO2-��4CO2��2H2O��Al3+��4HCO3��
C. ����������ϡ���ᷴӦ��3Fe + 2NO3-+ 8H+= 3Fe2++ 2NO��+ 4H2O
D. NH4HCO3��Һ������ NaOH ��Һ�����HCO3-+OH- =CO32-+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com