
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,正确的是( )
A. 钠在自然界中存在游离态
B. 钠是一种灰色的固体
C. 钠可以保存在煤油或CCl4中
D. 钠着火时可以用沙土扑灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g) ![]() 3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
A. 4molA + 2mol B B. 2molA + 1molB + 3molC + 1molD
C. 3molC + 1molD + 1molB D. 3molC + 1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,X,Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为;化合物BA4的电子式为 .
(2)化合物Y2X2中含有的化学键类型有(填序号).
A.离子键
B.极性共价键
C.非极性共价键
D.氢键
(3)化合物A2X和A2Z中,沸点较高的是(填化学式),其主要原因 .
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图列出了①~⑨九种元素在周期表中的位置: 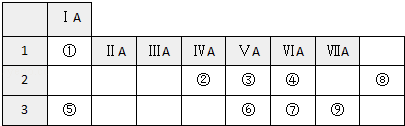
请按要求回答下列问题.
(1)元素⑧的名称是 , 元素⑧在周期表中所处位置 . 元素④的氢化物沸点高于⑦的氢化物沸点,原因是 .
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是(写氢化物的化学式).
(3)元素②④形成原子个数比为1:2的化合物的电子式是 .
(4)元素②形成的一类氢化物称为烷烃,通式是 , 其中(填分子式)有两种同分异构体,结构简式分别是 .
(5)用电子式表示⑤与⑦形成化合物的过程 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com