
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体![]() ;②第二份加足量
;②第二份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,以下推测正确的是
根据上述实验,以下推测正确的是![]()
A.一定不存在![]() ,
,![]() 可能存在
可能存在
B.![]() 一定存在,
一定存在,![]() 可能存在
可能存在
C.![]() 一定存在
一定存在
D.一定不存在![]()
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法不正确的是( )
A.能使酸性高锰酸钾溶液褪色
B.与氯化氢反应可以生成氯代苯乙烯
C.在催化剂存在下可以制得聚苯乙烯
D.与液溴混合后加入铁粉可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系一定正确的是( )
A.25℃时,pH均为10的氨水与 Ba(OH)2 溶液中,溶质的物质的量浓度之比为1:2
B.某温度下,0.1mol·L1 NaHCO3溶液的pH=8,则 c(OH)=106mol·L1
C.0.1mol·L1的HA溶液的pH=2,溶液中c(H+)=c(OH)+c(A)
D.pH=9的CH3COONa溶液与pH=9的氨水中,水电离出的c(OH)之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中不能用勒夏特列原理解释的是
A.H2(g) + I2(g)![]() 2HI(g)平衡后增大压强颜色变深
2HI(g)平衡后增大压强颜色变深
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.N2 + 3H2![]() 2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
D.向AgCl悬浊液中加入KI溶液,有黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取10 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2A=H+ + HA-,HA-![]() H+ + A2-。下列说法正确的是
H+ + A2-。下列说法正确的是
A.A2-可经过两步水解得到H2A
B.当用去NaOH溶液体积10 mL时,溶液中离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当滴加至中性时,溶液中有c(Na+)=c(HA-) + c(A2-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 molL-1的MOH溶液中逐滴加入0.1 molL-1 HCl溶液,滴定曲线如图所示。请回答下列问题:
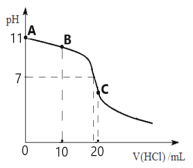
(1)请写出MOH的电离方程式__________________________,常温下,该碱的电离平衡常数Kb=_________。
(2)滴定到B点时,溶液中各离子浓度由大到小的顺序是_________________________。
(3)C点所对应的溶液呈_____性,用离子方程式表示其原因______________________。
(4)图中A、B、C三点溶液中水的电离程度由大到小的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.![]()
B.![]()
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com