
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
【答案】 NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq)ΔH=-(4a-b)kJ/mol 0.0125 mol/(L·min) < 60% a 3CO2+18H++18e-=C3H6+6H2O
NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq)ΔH=-(4a-b)kJ/mol 0.0125 mol/(L·min) < 60% a 3CO2+18H++18e-=C3H6+6H2O
【解析】
(1)三氯化氮(NCl3)其原子均满足8e-结构,形成三个共用电子对,氯化铵和氯气反应生成三氯化氮和氯化氢;
(2)根据不同反应的量产生的热量写出热化学方程式,根据盖斯定律计算所求反应的热效应;
(3)①根据化学反应平均速率公式v(NO)=![]() 计算;
计算;
②对比甲容器和乙容器,相同时间内乙容器转化的NO的量更多,表明乙容器的化学反应速率更快,则乙容器温度更高,据此判断焓变情况;
③根据等效平衡以及甲容器的反应情况计算丙容器中NO的转化率;
(4)①负极通燃料,正极通氧气;
②太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成。
(1)三氯化氮原子均满足8e-结构,故电子式为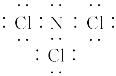 ;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2===NCl3+4HCl;
;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2===NCl3+4HCl;
故答案为: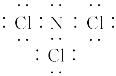 ;NH4Cl+3Cl2===NCl3+4HCl;
;NH4Cl+3Cl2===NCl3+4HCl;
(2)根据序号1的热化学方程式为:2CO2(g)+3NaOH(aq)===NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4a kJ/mol、序号2的热化学方程式为CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-b kJ/mol,根据盖斯定律可得:NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4a-b)kJ/mol;
故答案为:NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4a-b)kJ/mol;
(3)①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=v(CO)=![]() =0.0125 mol/(L·min);
=0.0125 mol/(L·min);
故答案为:0.0125 mol/(L·min);
②根据甲乙容器可知,乙容器80 min达到平衡,甲容器在120 min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应,ΔH<0;
故答案为:<;
③甲与丙的温度一样,故平衡常数不变。甲容器在300 ℃下的平衡常数为:

K=![]() =
=![]() =2.11
=2.11
丙容器在300 ℃下的平衡常数为:
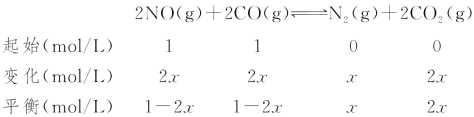
K=![]() =2.11,
=2.11,
解得x=0.3 mol/L,故丙容器达到平衡时,CO的转化率为60%,
故答案为:60%;
(4)①由图片可知,与a相连的电极:CO2→丙烯,发生还原反应,作阴极,故a为太阳能电池的负极;②生成丙烯的电极反应式为:3CO2+18H++18e-===C3H6+6H2O;
故答案为:a;3CO2+18H++18e-=C3H6+6H2O。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.乙烯和苯都能使溴水褪色,褪色的原因相同
C.用溴水可鉴别苯酚溶液、甲苯和2,4-己二烯
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书 写正确的是( )
离子组 | 加入试剂 | 发生反应的离子方程式 | |
A |
| NaOH溶液 |
|
B |
| BaCl2溶液 |
|
C |
| 少量KOH溶液 |
|
D |
| 通入少量SO2 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5中离子中的某几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为确认该溶液组成进行如下实验:
为确认该溶液组成进行如下实验:![]() 取
取![]() 该溶液,加入
该溶液,加入![]() 溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀
溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀![]() 再将滤液稀释至100ml,测得滤液中
再将滤液稀释至100ml,测得滤液中![]() 为
为![]() 另取
另取![]() 该溶液,加入足量的
该溶液,加入足量的![]() 溶液,生成白色沉淀
溶液,生成白色沉淀![]() 由此可得出关于原溶液组成的正确结论是
由此可得出关于原溶液组成的正确结论是![]()
A.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() 、
、![]()
B.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() ,可能含有
,可能含有![]()
C.![]() 为
为![]() ,
,![]() 为
为![]()
D.![]() 为
为![]() ,
,![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:Ca2+、NH4+、Br、CH3COO
B.室温下 =1012的溶液中:Fe2+、Al3+、NO3-、SO42-
=1012的溶液中:Fe2+、Al3+、NO3-、SO42-
C.室温下水电离的c(H+)=10-12 mol·L-1的溶液:K+、HCO3-、Cl-、Ca2+
D.pH=13的溶液中:CO32-、Na+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体![]() ;②第二份加足量
;②第二份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,以下推测正确的是
根据上述实验,以下推测正确的是![]()
A.一定不存在![]() ,
,![]() 可能存在
可能存在
B.![]() 一定存在,
一定存在,![]() 可能存在
可能存在
C.![]() 一定存在
一定存在
D.一定不存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
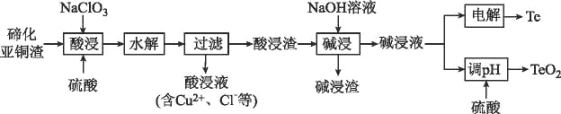
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:
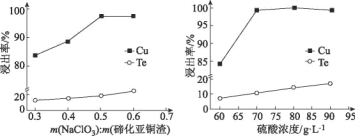
选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一。
(1)氢氧燃料电池是一种高效无污染的清洁电池,用KOH溶液作电解质溶液,其负极反应式为_____________,理论上,正极消耗氧气2.8 L(标况下)时,电路中有__________mol e-通过。
(2)高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制双控开关,可交替得到H2和O2。

①太阳能光伏电池是将光能转化为__________能。
②当连接K1时可制得____________气体。
③当连接K2时,电极2附近pH_________(填“变大”、“变小”或“不变”)。
④当连接K2时,电极3作______极,其电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,Ⅰ是一种萜类化合物,它的合成路线如图所示:

已知:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)A的名称是________,![]() 的反应类型是_________;
的反应类型是_________;
(2)流程中设计![]() 这步反应的作用________;
这步反应的作用________;
(3)![]() 第一步的化学反应方程式__________;
第一步的化学反应方程式__________;
(4)B含有一个环状结构,其结构简式为__________;它的同分异构体有多种,其中符合下列条件的有____________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与![]() 反应生成
反应生成![]()
(5)F与![]() 按物质的量
按物质的量![]() 发生反应生成G的化学方程式为_________;
发生反应生成G的化学方程式为_________;
(6)请以![]() 、
、![]() 为原料,结合题目所给信息,制备高分子化合物
为原料,结合题目所给信息,制备高分子化合物 的流程________。
的流程________。
例如:原料![]() ……目标化合物
……目标化合物

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com