
【题目】某溶液中可能含有下列5中离子中的某几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为确认该溶液组成进行如下实验:
为确认该溶液组成进行如下实验:![]() 取
取![]() 该溶液,加入
该溶液,加入![]() 溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀
溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀![]() 再将滤液稀释至100ml,测得滤液中
再将滤液稀释至100ml,测得滤液中![]() 为
为![]() 另取
另取![]() 该溶液,加入足量的
该溶液,加入足量的![]() 溶液,生成白色沉淀
溶液,生成白色沉淀![]() 由此可得出关于原溶液组成的正确结论是
由此可得出关于原溶液组成的正确结论是![]()
A.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() 、
、![]()
B.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() ,可能含有
,可能含有![]()
C.![]() 为
为![]() ,
,![]() 为
为![]()
D.![]() 为
为![]() ,
,![]() 为
为![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素 m、n、p、q 在元素周期表中的排列如图所示,其中 n 的最高价氧化对应的水化物既能与强酸反应,也能与强碱反应,下列说法正确的是( )
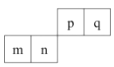
A.元素n位于元素周期表第3周期,第ⅢA族
B.单质与水反应置换出氢气的能力:m<n
C.简单离子半径:m>q
D.最高价氧化物对应水化物的碱性:m<n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系一定正确的是( )
A.25℃时,pH均为10的氨水与 Ba(OH)2 溶液中,溶质的物质的量浓度之比为1:2
B.某温度下,0.1mol·L1 NaHCO3溶液的pH=8,则 c(OH)=106mol·L1
C.0.1mol·L1的HA溶液的pH=2,溶液中c(H+)=c(OH)+c(A)
D.pH=9的CH3COONa溶液与pH=9的氨水中,水电离出的c(OH)之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中不能用勒夏特列原理解释的是
A.H2(g) + I2(g)![]() 2HI(g)平衡后增大压强颜色变深
2HI(g)平衡后增大压强颜色变深
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.N2 + 3H2![]() 2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
D.向AgCl悬浊液中加入KI溶液,有黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 molL-1的MOH溶液中逐滴加入0.1 molL-1 HCl溶液,滴定曲线如图所示。请回答下列问题:
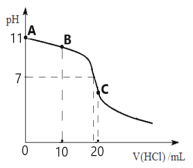
(1)请写出MOH的电离方程式__________________________,常温下,该碱的电离平衡常数Kb=_________。
(2)滴定到B点时,溶液中各离子浓度由大到小的顺序是_________________________。
(3)C点所对应的溶液呈_____性,用离子方程式表示其原因______________________。
(4)图中A、B、C三点溶液中水的电离程度由大到小的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验方法和结论都正确的是
A.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
B.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热
C.图中酸式滴定管读数为12.20 mL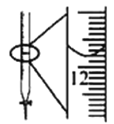
D.若用已知浓度的KMnO4溶液去测定某溶液中Fe2+浓度,KMnO4溶液放在碱式滴定管中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com