
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
【答案】B
【解析】
A选项,c(OH-)/c(H+)=10-13,c(H+)=1mol·L-1,溶液呈酸性,Fe2+、NO3-发生反应,不能大量共存,故A错误;
B选项,1 L 0.1molL-1的CH3COONa溶液中存在电荷守恒,c(OH-) + c(CH3COO-)= c(Na+) + c(H+),Na+物质的量为0.1mol,所以CH3COO-和OH-的总数大于0.1NA,故B正确;
C选项,电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:2Fe3+ +Cu = 2Fe2++Cu2+,故C错误;
D选项,H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:![]() O2(g) +H2(g) = H2O(l) ΔH = -a kJ·mol-1,故D错误;
O2(g) +H2(g) = H2O(l) ΔH = -a kJ·mol-1,故D错误;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(mol·L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
①25℃时,浓度均为0.1mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___。中和等体积、等pH的HCOOH和HCN消耗NaOH的量___(填“前者大”“后者大”或“相等”)。
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是___。
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是____
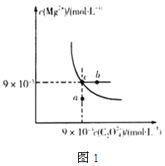
A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)Mg(OH)2(s)+C2O42-(aq)平衡常数K=![]()
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
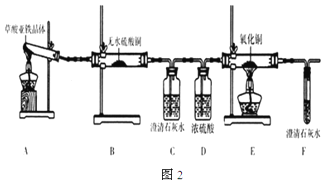
①从环保角度考虑,该套实验装置的明显缺陷是___。
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯。
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___。草酸亚铁晶体分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物的处理,对缓解和治理环境污染、保护我们赖以生存的地球,具有十分重要的意义。
(1)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5/kJmol
N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
则C(s)+2NO(g)═CO2(g)+N2(g) 的△H=_____kJ/mol。
(2)在一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)4CO2(g)+N2(g),测得相关数据如表所示:
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
①在0~5 min内,用CO2的浓度变化表示的反应速率为_____。
②此温度下的化学平衡常数K的表达式为_____。
(3)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)![]() CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
①下列描述能说明上述反应已达平衡的是_____(填标号)。
A.活性炭的质量不再变化
B.容器中气体的密度保持不变
C.2v(NO)正 =v(N2)逆
D. 保持不变
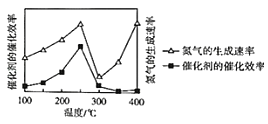
保持不变
②压强为p时,催化剂的催化效率、氮气的生成速率与温度的关系如图所示。当氮气的生成速率主要取决于温度时,对应的温度范围是_____。
(4)肼(N2H4)是无色液体,具有强还原性。
①肼的水溶液显弱碱性,其电离过程与NH3H2O类似,则第一步电离方程式为_____。
②新型N2H4燃料电池产物对环境没有污染,该电池以固体氧化物为电解质(能传导O2﹣)。写出负极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
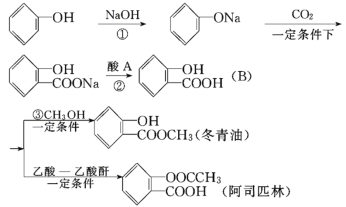
(1) 冬青油含有的官能团名称为________________
(2)B溶于冬青油致使产品不纯,加入下列哪种试剂后再分液即可除去_____
(A) NaOH 溶液 (B) Na2CO3溶液 (C) NaHCO3溶液 (D) Na
(3)写出第①步反应的化学方程式_________________________________.
(4)写出反应③的化学方程式_____________________________________
(5)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
(6)化合物M是冬青油的同分异构体,与冬青油具有相同的官能团,能与氯化铁发生显色反应,苯环上有两个对位的取代基,写出两种M可能的结构简式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理含氮的化合物,在生产、生活中有重要意义。回答下列问题:
(1)在紫外光照射的条件下,氯气与偏二甲肼[(CH3)2NNH2]可快速反应,偏二甲肼转化为CH3OH和N2,该反应的化学方程式为______________________________。
(2)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。25℃时,连二次硝酸的电离常数Ka1=6.17×10-8,Ka2=2.88×10-12
①25℃时0.1molL-1NaHN2O2溶液中离子浓度由大到小的顺序为____________________________。
②25℃时向0.1 molL-1连二次硝酸溶液中逐滴滴入NaOH溶液,当溶液的pH=10时,C(N2O22-)/ C(H2N2O2)=________。
(3)亚硝酰氯可由NO与Cl2反应制得,反应原理为2NO(g)+ Cl2 (g)![]() 2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
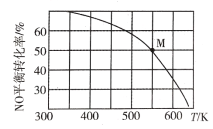
①该反应的△H_____(填“>”“<”或“=”)0。
②M点时容器内NO的体积分数为____。
③若反应一直保持在P压强条件下进行,则M点的平衡常数Kp=____________,(用含P的表达式表示)。
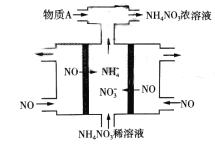
(4)工业上电解NO制备NH4NO3可以变废为宝,其工作原理如图所示、电解时阳极反应式为___________,为使电解产物全部转化为NH4NO3,需要补充物质A,物质A化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
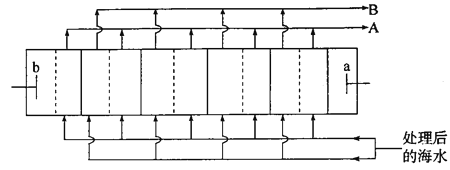
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
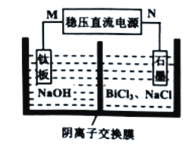
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:
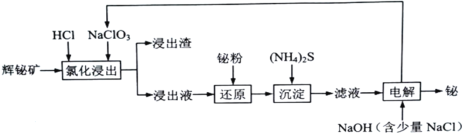
已知:I.“氯化浸出”过程中,需分批多次加入NaClO3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
(5)“电解”过程的简易装置如图所示。装置中N为电源的________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成分的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_______(填名称),溶液变蓝,则证明苹果中含有淀粉。
(2)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程图,试回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
①写出化学方程式,并注明反应类型。
B与醋酸反应:____________________________,属于______________反应。
B→C____________________________,属于____________________________反应。
②可用于检验A的试剂是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com